
英文标题:Ammonia-induced lysosomal and mitochondrial damage causes cell death of effector CD8+T cells
中文标题:氨诱导的溶酶体和线粒体损伤导致效应 CD8+T细胞死亡
发表期刊:nature cell biology
影响因子:17.3
氨作为细胞代谢的有毒副产物,长期以来被认为与肝衰竭导致的高氨血症及神经损伤密切相关。然而,其在肝外组织中的生理病理作用尚不明确。CD8+Teff细胞在对抗病原体或肿瘤过程中快速增殖,这一过程依赖谷氨酰胺分解代谢提供能量,但同时产生大量氨。传统观点认为,肝外细胞通过尿素循环以外的途径清除氨,但快速增殖的T细胞是否因氨积累导致功能损伤或死亡仍未知。此前研究发现,记忆T细胞通过尿素循环解毒氨以维持存活,但效应T细胞因缺乏关键酶CPS1可能无法有效清除氨。本研究首次揭示氨通过溶酶体-线粒体互作诱导T细胞死亡的新机制,为优化T细胞免疫治疗提供了理论依据。
1、氨诱导CD8+Teff细胞死亡
为验证氨积累是否直接导致效应T细胞死亡,先将 CD45.1+OT-I T细胞过继转移至CD45.2+小鼠体内,随后用表达OVA的李斯特菌(Listeria monocytogenes expressing ovalbumin, Lm-OVA)感染这些小鼠,利用靶向代谢组学技术动态检测细胞内氨水平,同时使用流式细胞术监测细胞存活。结果显示:感染后第12天,效应T(Teff)细胞内氨水平达峰值,细胞死亡比例显著升高(图1a-c)。体外使用SIINFEKL肽刺激后,OT-I Teff细胞自第 10天起氨水平开始上升,随后出现细胞死亡,而培养基中始终未检测到氨(图1d-e)。外源性NH4Cl处理进一步加速细胞死亡(图1f),氨甲酰磷酸合酶1(Carbamoylphosphate synthase 1, CPS1)可减轻CD8+记忆T细胞的氨中毒,但在CD8+Teff细胞中未检测到CPS1表达(图1g)。15N标记的 NH4Cl示踪实验也证实,细胞中m+1氨甲酰磷酸无显著增加(图1h)。过表达CPS1后,细胞内氨甲酰磷酸及尿素循环代谢物显著增多,同时Teff细胞的尿素生成量增加(图1i-j)。此外,CPS1过表达或4-苯基丁酸(4-Phenylbutyric acid, 4PBA)处理均可有效降低氨水平并挽救细胞存活(图1k-n)。形态学观察显示,死亡的CD8+Teff细胞在收缩期出现独特的胞质空泡,该特征在其他类型细胞死亡中未被观察到(图1o)。细胞内ATP水平检测表明,晚期活化或氨处理的CD8+Teff细胞ATP生成显著减少(图1p-q)。综上,本研究证实氨积累可诱导效应CD8+T细胞发生独特形式的死亡。
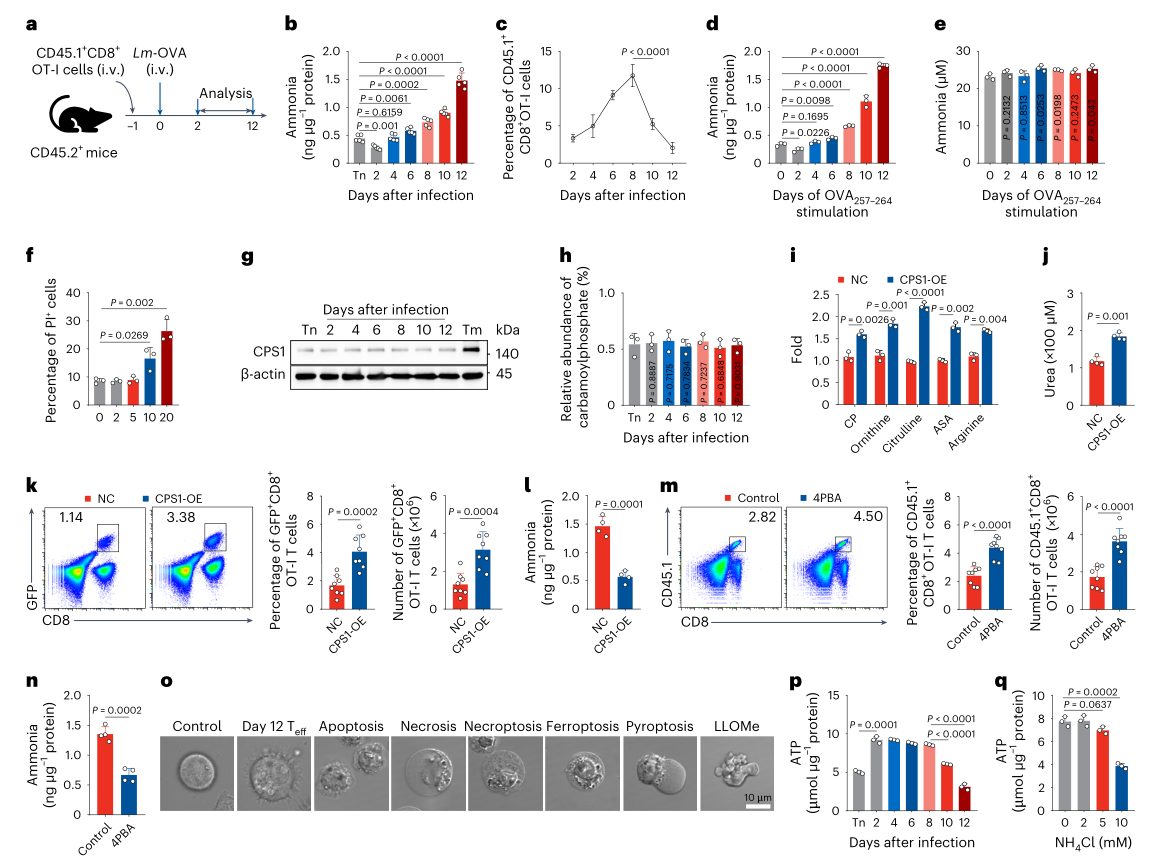
图1.氨诱导效应CD8+Teff细胞死亡
2、谷氨酰胺衍生的氨有助于效应T细胞死亡
为明确Teff细胞氨代谢来源及调控靶点,研究者利用15N标记谷氨酰胺示踪,并以谷氨酰胺酶1(Glutaminase 1, GLS1)抑制剂及无谷氨酰胺培养基处理。结果显示:GLS1抑制剂显著降低氨水平,提升Teff细胞存活率(图2b-c);同位素示踪表明,Lm-OVA感染8天后,15N标记的谷氨酰胺在 CD8+Teff细胞积累(图2d-e),且15N同位素体存于鸟苷一磷酸等代谢物中,提示早期氨用于合成代谢,后期非分裂状态下氨积累(图2f-h)。感染第1天抑制GLS1不影响氨水平,但阻碍OT-I Teff细胞增殖(图2i-k);敲除GLS1后,细胞数量增加、氨水平下降,感染8天谷氨酰胺在CD8+Teff细胞内积聚(图2l-o)。综上,谷氨酰胺是诱导CD8+Teff细胞死亡的氨主要来源。
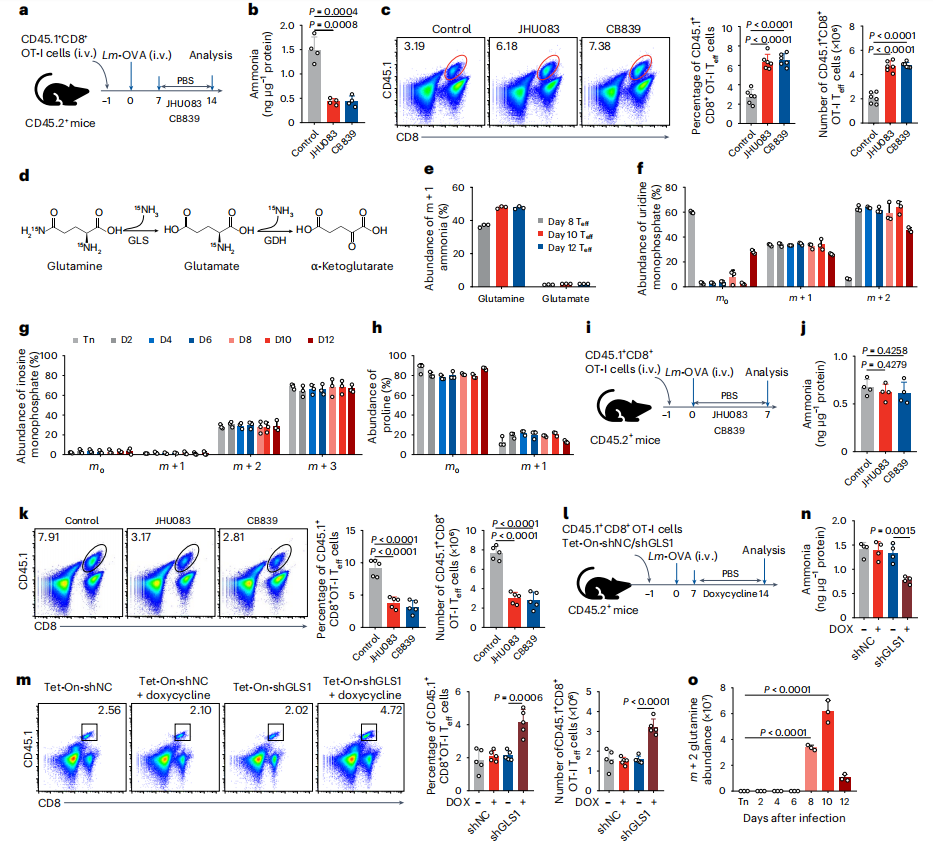
图2.谷氨酰胺衍生的氨有助于效应T细胞死亡
3、氨通过RHCG转运至溶酶体引发功能损伤
利用免疫荧光定位RHCG(氨转运蛋白),并检测溶酶体pH、膜通透性及蛋白酶活性。结果显示,体内外Teff细胞中溶酶体氨水平随时间上升,细胞死亡时达峰值(图3a);L-谷氨酰胺-¹⁵N₂示踪证实溶酶体氨源于线粒体(图3b)。抑制GLS1可降低OT-I Teff细胞溶酶体铵水平(图3c),铵积累伴随溶酶体pH升高(图3d)。活化12天的T细胞中,组织蛋白酶B/D、β-半乳糖苷酶及α-甘露糖苷酶活性下降,溶酶体膜透化(LMP)增加(图3e-f),该损伤可被GLS1抑制剂逆转(图3g-i)。
通过敲除/过表达氨转运蛋白发现,CD8⁺Teff细胞高表达RHCG,晚期活化细胞溶酶体中RHCG显著增加(图3j-k)。敲低RHCG降低溶酶体氨水平,过表达 RHCG虽未增加胞外氨,但显著提升溶酶体氨含量,同时降低线粒体氨水平(总氨量不变)(图3l-n),并加速CD8⁺Teff细胞死亡,该效应可被GLS1抑制剂阻断。此外,RHCG过表达导致溶酶体pH升高、膜透化加剧及酶活性降低,而JHU083可恢复溶酶体功能(图3q-s)。这些结果表明,排出的氨通过RHCG转运到溶酶体中。
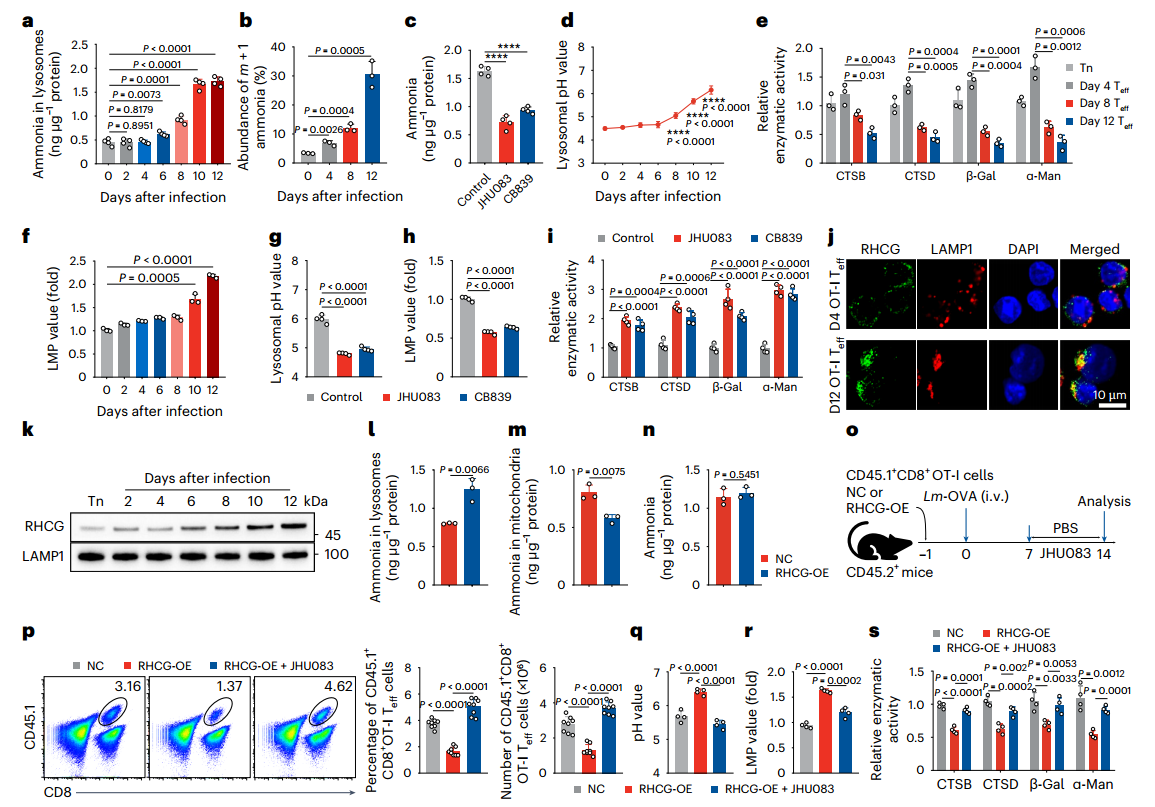
图3.氨存储在效应CD8+Teff细胞的溶酶体中
4、氨滞留导致线粒体损伤
为探究氨在线粒体滞留的效应,研究人员利用透射电子显微镜观察线粒体超微结构,并开展CPS1过表达或GLS1抑制剂干预实验。结果显示:刺激后第8天,T细胞线粒体氨水平显著升高(图4a);体内外晚期CD8+Teff细胞均出现线粒体膜电位降低(图4b)。尽管早期与晚期Teff细胞线粒体数量无差异,但晚期细胞中线粒体DNA拷贝数显著减少(图4c-d),且线粒体形态呈现明显损伤(图4e)。为验证线粒体损伤与氨滞留的因果关系,通过体内过表达CPS1降低氨水平,或使用GLS1抑制剂减少过继转移OT-I细胞的氨生成。结果表明,两种干预均有效挽救线粒体损伤(图4f-k)。综上,线粒体氨滞留可引发严重的线粒体结构与功能损伤。
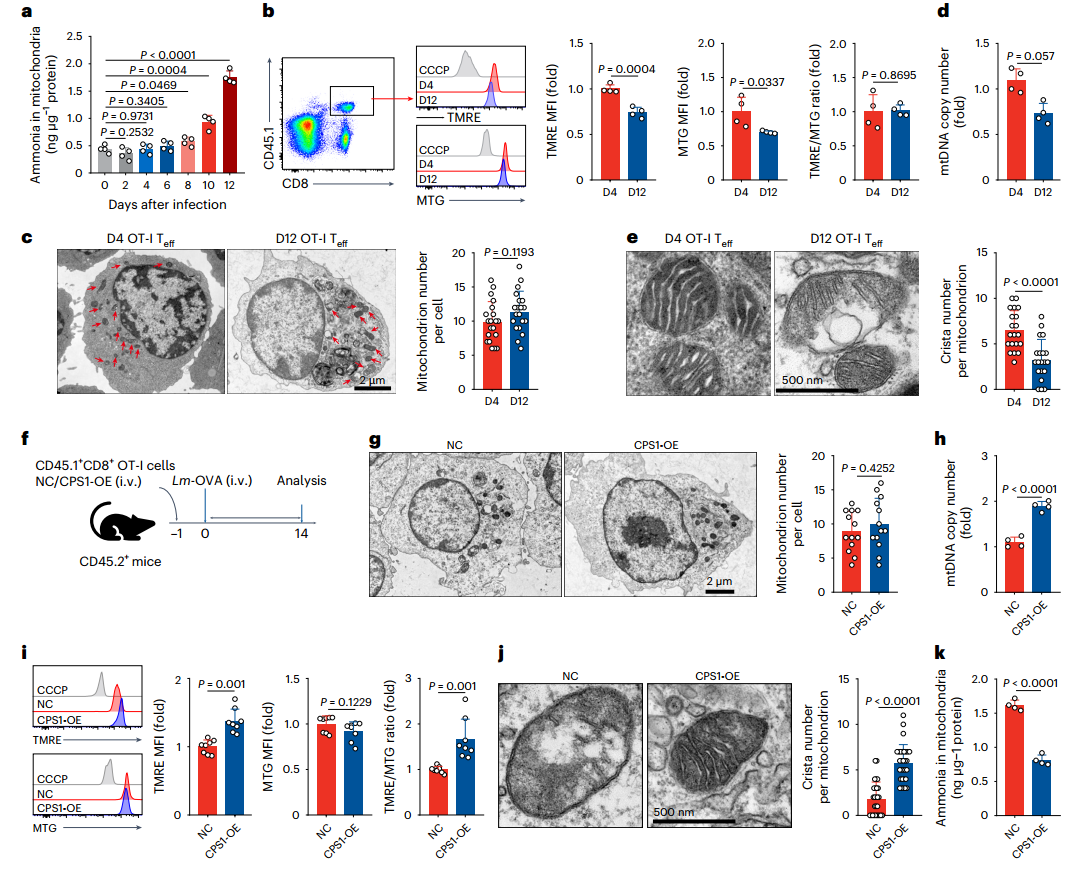
图4.氨滞留导致线粒体损伤
5、受损的线粒体不能通过自噬清除
为解析溶酶体-线粒体互作在氨诱导死亡中的机制,研究通过WB检测LC3-II/p62表达,利用免疫荧光观察自噬体-溶酶体共定位,并使用溶酶体酸化剂 C381干预。
电子显微镜观察显示,CD8+Teff细胞内线粒体样结构极少(图5a),且TEN刺激未引起PINK1和 Parkin蛋白水平变化(图5b)。LC3荧光斑点与线粒体的共定位分析表明,虽第12天LC3斑点增多,但在第4天和第12天的Teff细胞中均未检测到两者共定位(图5c),提示线粒体自噬及巨自噬过程受损。
进一步发现,感染后期Teff细胞中LC3-II持续积累,但p62未降解,证实自噬体-溶酶体融合障碍(图5d-e);电镜下可见单层膜自溶体数量显著增加,内含未完全降解的细胞质成分及线粒体嵴碎片(图5f-g)。而C381处理可显著降低体内外活化的OT-I Teff细胞死亡率(图5h-i)。综上,溶酶体pH升高在氨诱导的Teff细胞死亡中起关键作用,受损线粒体无法通过自噬途径有效清除,或为该死亡模式的重要特征。
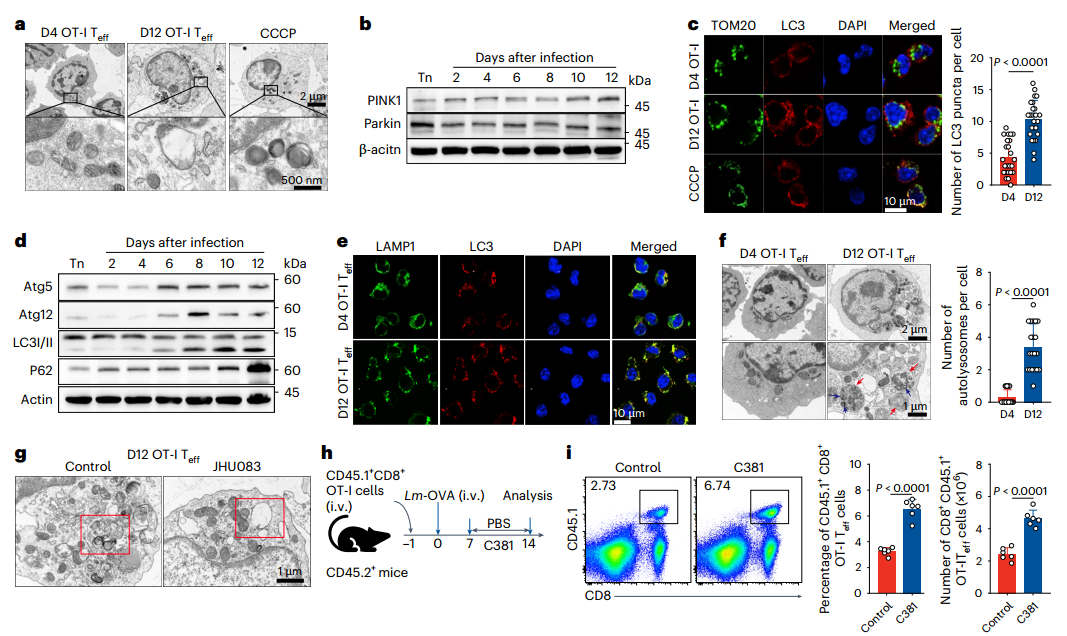
图5.受损线粒体无法通过自噬清除
6、氨死亡阻断增强癌症的过继性T细胞治疗
为验证干预氨死亡通路对肿瘤免疫治疗的增效作用,研究构建B16-OVA黑色素瘤小鼠模型,将OT-I Teff细胞过继转移至荷瘤小鼠,随即联合GLS1抑制剂或溶酶体酸化剂C381进行治疗,并动态监测肿瘤体积及T细胞浸润情况。结果显示,过继转移后第4-10天,肿瘤浸润的OT-I细胞出现氨积聚,伴随溶酶体pH值显著升高(图6a-c)。经GLS1抑制剂处理14天后,肿瘤生长明显受限,小鼠生存期显著延长(图6d-g);进一步分析证实,这与肿瘤、淋巴结、脾脏和肺部中转移细胞数量增多的情况相一致(图6h)。机制层面,GLS1抑制剂可降低肿瘤浸润OT-I细胞的溶酶体pH值及膜透化程度,同时恢复溶酶体酶活性(图6i-k)。此外,通过过继转移携带诱导型GLS1 shRNA的OT-I Teff细胞,或过表达CPS1的OT-I T细胞至荷瘤小鼠,均观察到肿瘤生长减缓、小鼠生存期延长(图6l-n、p-s),且肿瘤微环境中OT-I Teff细胞数量显著增多(图6o)。综上,阻断氨死亡通路可通过改善T细胞在肿瘤微环境中的持久性,显著增强过继性T细胞治疗的抗肿瘤效果。
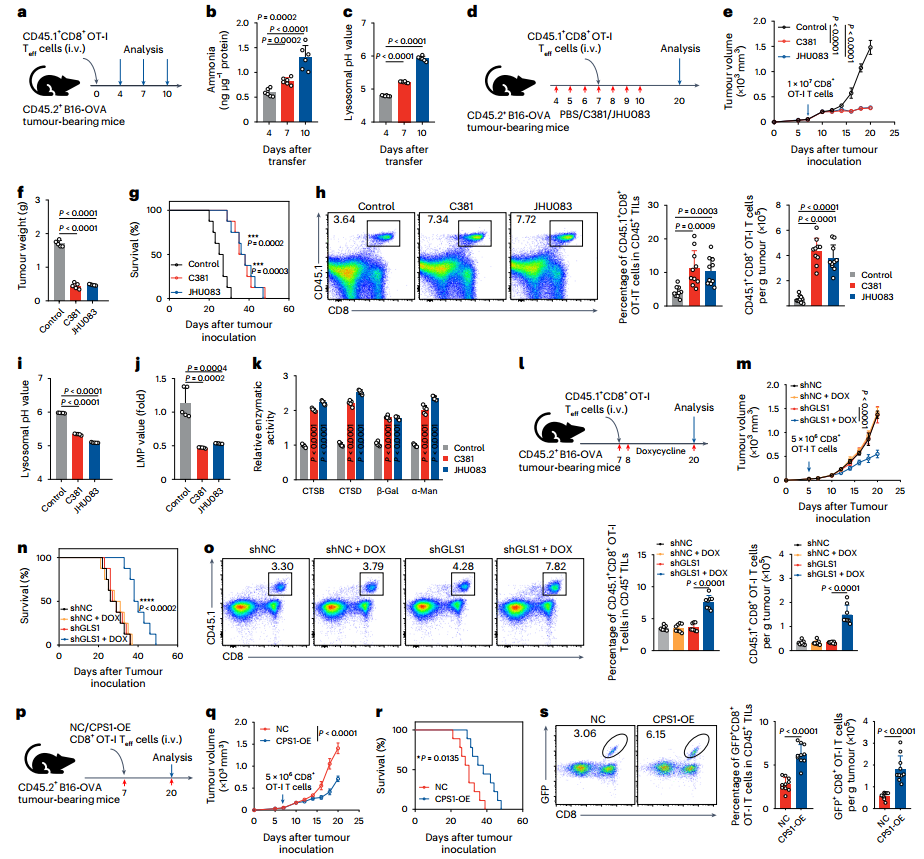
图6.氨死亡的阻断作用增强了针对癌症的过继性T细胞治疗效果
本研究首次揭示氨通过“溶酶体碱化-线粒体损伤-自噬受阻”级联反应诱导效应T细胞死亡的新机制,命名为“氨死亡”。这一发现不仅拓展了细胞死亡的类型认知,更为提高T细胞免疫治疗疗效提供了新策略:通过干预谷氨酰胺代谢或调节溶酶体微环境,可有效维持Teff细胞存活及功能,为实体瘤治疗开辟了全新方向。










