
文章标题:Streptococcus anginosus promotes gastric inflammation, atrophy, and tumorigenesis in mice
客户单位:香港中文大学
期刊:Cell
影响因子:64.5
百趣提供服务:蛋白质组学
胃癌(Gastric cancer, GC)是全球第五大常见癌症,也是导致癌症死亡的主要原因。幽门螺杆菌(Helicobacter pylori, H. pylori)是胃癌的主要危险因素,被列为I型致癌物。但在感染幽门螺杆菌的个体中,只有1%-3%的人最终发展为GC,这表明还有其他因素参与其中。一些新的证据表明,大量的非H. pylori微生物群存在于胃粘膜中,它们的失控可能在胃癌发生中起作用。然而,与胃癌发生相关的非H. pylori驱动细菌尚未被发现。
2024年1月30日,香港中文大学于君老师团队在Cell在线发表题为"Streptococcus anginosus promotes gastric inflammation, atrophy, and tumorigenesis in mice"的研究论文,该研究发现GC患者胃粘膜中有丰富的咽峡炎链球菌(Streptococcus anginosus, S.anginosus)。S.anginosus定植于小鼠胃并引起急性胃炎。在常规小鼠模型中,S.anginosus感染可诱发进行性慢性胃炎、壁细胞萎缩、粘液化生和异型增生,并在无菌小鼠中得到证实。此外,在致癌物诱导的胃肿瘤形成和YTN16 GC细胞同种异体移植中,S.anginosus加速了GC进展。S.anginosus可破坏胃屏障功能,促进细胞增殖,抑制细胞凋亡。作者进一步进行了机制研究,采用Pull-Down实验来确定S.anginosus与宿主受体结合的细菌粘附素,通过质谱检测到三种蛋白并找到关键膜蛋白TMPC(百趣生物为其提供蛋白质谱检测服务),TMPC可与胃上皮细胞上的膜联蛋白Annexin A2(ANXA2)受体相互作用。TMPC与ANXA2相互作用诱导丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)活化。ANXA2基因敲除后,S.anginosus对MAPK的诱导作用被阻断。本项研究揭示了S.anginosus是一种病原体,通过与TMPC-ANXA2-MAPK轴上的胃上皮细胞直接相互作用而促进胃肿瘤的发生。
1、 胃炎患者胃粘膜中富含S.anginosus
作者首先采用自己内部的16S rRNA基因测序数据集分析了胃癌发生的不同阶段中S.anginosus的丰度。与浅表性胃炎(superficial gastritis, SG, N=110)相比,萎缩性胃炎(atrophy gastritis, AG, N=117)和肠化生(intestinal metaplasia(IM, N=45)患者的S.anginosus水平明显升高,在GC(N=39)患者中达到最高水平(图1 A)。S.anginosus对胃部感染长期影响,通过动物模型实验,将感染模型延长到3、6、9和12个月,结果发现 S.anginosus感染小鼠3个月后诱发慢性胃炎(图1 B和C)。
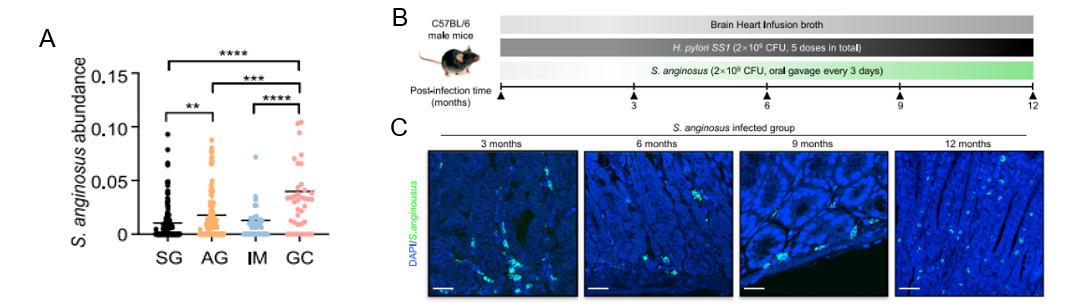
图1 S.anginosus在不同类别胃活检样本中的丰度分布图及其染促进小鼠慢性胃炎
2、 S.anginosus诱导小鼠产生胃炎萎缩化生异型增生序列
胃肿瘤的发生过程沿着萎缩-化生-异型增生序列的癌前病变进行,胃炎是一个主要的危险因素。既然S.anginosus可诱发慢性胃炎,那么作者思考:长期感染是否会引发胃粘膜的癌前病变。通过研究发现,在感染9个月时,S.anginosus感染引起轻度壁细胞萎缩,12个月时发展为中度至重度萎缩(p=0.01),并检测到粘液化生,形成了低级别的不典型增生(图2 A~D)。对小鼠胃组织的荧光原位杂交(Fluorescence in situ hybridization, FISH)分析表明,与非化生区相比,S.anginosus在化生/异型增生区域中较为丰富。以H. pylori为阳性对照,H. pylori可更快地引起胃萎缩;但是在12个月时,粘液化生的数量低于S.anginosus诱导的,并且没有发现异型增生(图2 A、B和E)。在感染9个月和12个月后,与BHI对照组相比,S.anginosus引起胃萎缩(P<0.05)。为了确证粘液化生,作者进行了阿尔新蓝的组织学染色,这是一种常用的指示胃中杯状细胞的染料,用于诊断IM。在12个月龄时,感染链球菌的小鼠胃粘膜内可见阿尔辛蓝阳性细胞,而BHI对照组小鼠胃粘膜内未见阿尔辛蓝阳性细胞。作者还进行了化生标记物单叶格里夫尼亚凝集素II(Griffonia simplicifolia lectin II, GSII)的免疫荧光染色(图2 F)。与H&E染色下的化生改变一致,感染后12个月,胃腺内GSII阳性细胞增加。
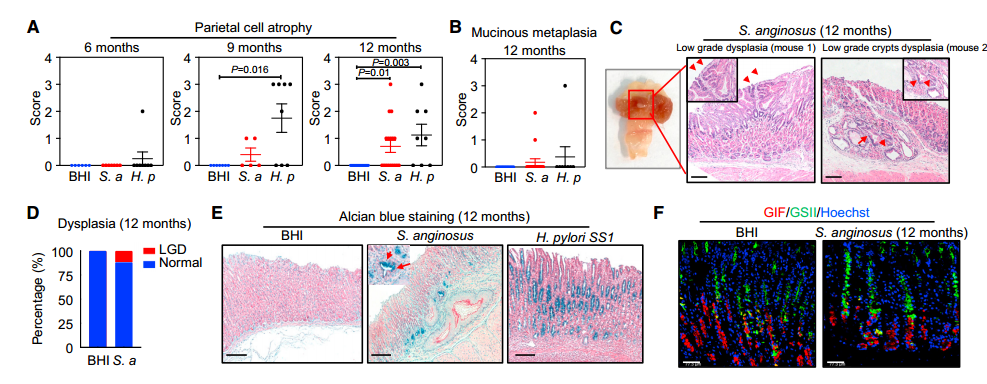
图2 S.anginosus引起小鼠胃萎缩、化生、异型增生
3、 S.anginosus促进胃肿瘤的发生
作者通过建立N-甲基-N-亚硝脲(N-methyl-N-nitrosourea, MNU)诱导的GC小鼠模型(图3 A)来阐明S.anginosus在胃肿瘤发生中的作用。结果表明:MNU处理9个月后,胃窦部出现胃部病变。感染S.anginosus的小鼠肿瘤发生率(10/11)显著高于对照组(4/13)和幽门螺杆菌感染小鼠(12/18,P<0.003)(图3 B)。与只接受MNU处理的对照小鼠相比,感染S.anginosus的小鼠的肿瘤数量(p=0.006)和肿瘤大小(p<0.05)都显著增加(图3 C)。组织学检查显示,36.4%的小鼠有高度不典型增生(high-grade dysplasia, HGD),高于单独接受MNU处理的小鼠(15.4%)(图3 D),与H. pylori感染的小鼠(22.2%HGD和5.6%腺癌)相当。Ki-67染色显示,与MNU处理的对照小鼠相比,S.anginosus的小鼠细胞增殖更高(p<0.05)(图3 E)。这些发现共同推断,S.anginosus加速了MNU诱导的小鼠胃肿瘤的发生。
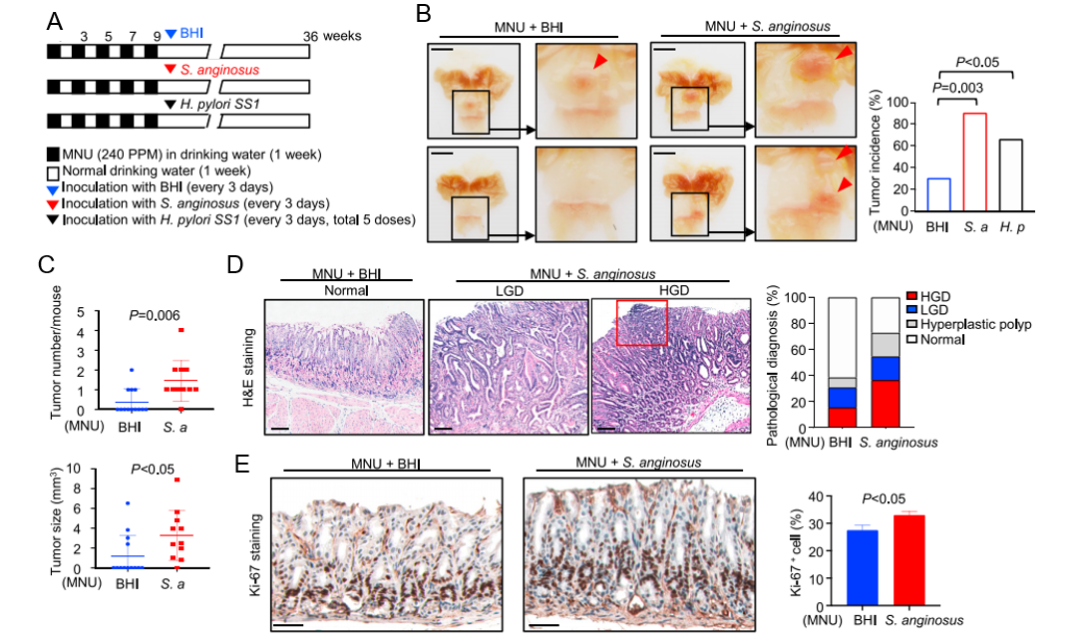
图3 S.anginosus加速小鼠胃癌的发生
4、TMPC-Annexin A2轴介导S.anginosus定植并激活MAPK信号转导
在小鼠胃粘膜中发现了S.anginosus的定植后,接着对该细菌的黏附特性进行了研究。通过细菌附着和入侵法以及扫描电子显微镜(scanning elec-tron microscopy, SEM)发现,S.anginosus (<1 μm,球状)附着在AGS和GES-1细胞表面,具有清晰的病原-宿主界面。这表明S.anginosus可能通过与胃上皮细胞直接相互作用而发挥致癌作用。
进一步通过biotin-pull-down、GST-pull-down,COIP等互作实验以及sgRNA细胞实验对S.anginosus附着和侵袭胃上皮细胞的潜在机制进行研究,发现和证实了S.anginosus通过其表面蛋白TMPC与胃上皮细胞上的ANXA2受体结合,介导S.anginosus对胃上皮细胞的定植,在肿瘤发生中起重要作用(图4 A~G)。
为了进一步研究S.anginosus诱发胃癌的下游信号机制,作者对感染S.anginosus的普通小鼠(12个月)和对照组小鼠的胃组织进行了rna-seq测序以及WB验证等实验,最终发现和证实了S.anginosus通过TMPC-ANXA2相互作用促进MAPK信号转导,进而引起了其在胃上皮细胞中的促癌作用(图4 L~Q)。
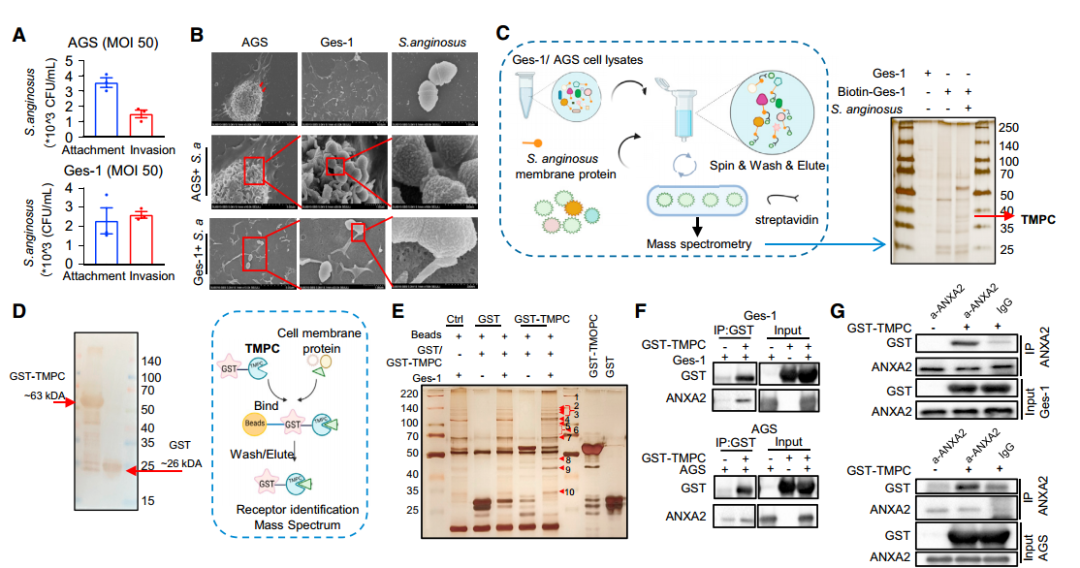
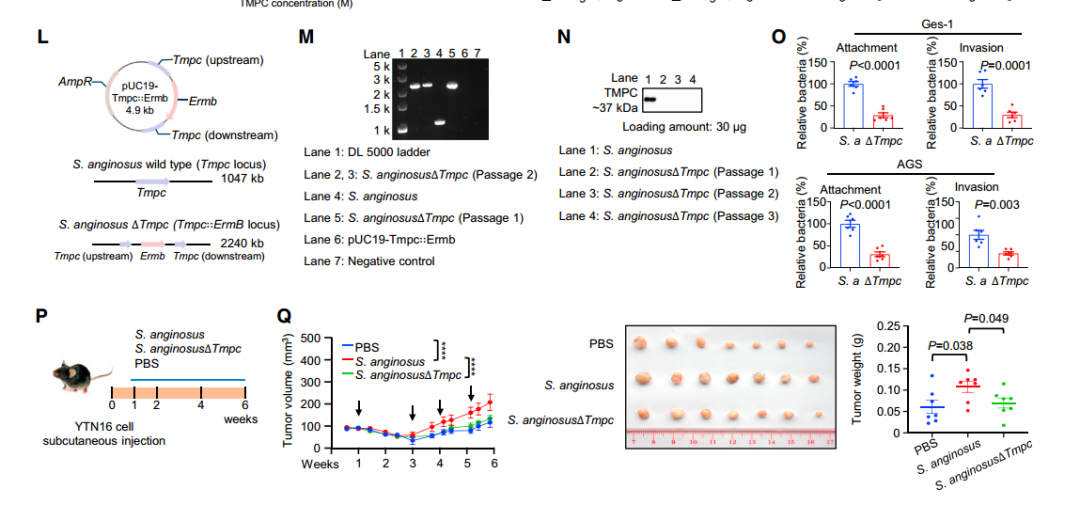
图4 S.anginosus通过TMPC-ANXA2轴激活MAPK信号通路促进胃肿瘤的发生
综上所述,作者鉴定了一种非H. pylori驱动细菌S.anginosus会促进胃肿瘤的发生。在小鼠模型中,S.anginosus感染诱导胃炎和癌前病变、萎缩化生-异型增生序列,并加速胃肿瘤的发生。进一步发现了S.anginosus表面毒性因子TMPC与胃上皮细胞表面的ANXA2结合,引起细菌的附着、侵袭,以及致癌基因MAPK信号的下游激活。本项研究提供了S.anginosus在胃癌发生过程中作为致病病原体的证据。
-
 深化合作 | SCIEX全球副总裁蔡俊松一行来访百趣,共探合作新方向近日,SCIEX全球副总裁、中国区总经理蔡俊松先生与中国市场副总监江峥女士莅临上海百趣生物医学科技有限公司(以下简称“百趣生物”)苏州产能中心。此次访问,蔡俊松先生、江峥女士与百趣生物总裁邓军亮先生及市场中心总监程羿淳女士进行了深入的交流。2024-04-16
深化合作 | SCIEX全球副总裁蔡俊松一行来访百趣,共探合作新方向近日,SCIEX全球副总裁、中国区总经理蔡俊松先生与中国市场副总监江峥女士莅临上海百趣生物医学科技有限公司(以下简称“百趣生物”)苏州产能中心。此次访问,蔡俊松先生、江峥女士与百趣生物总裁邓军亮先生及市场中心总监程羿淳女士进行了深入的交流。2024-04-16 -
 薅羊毛 | 组学推荐,豪礼送不停时光荏苒,百趣生物已经迎来了第12个生日!我们始终坚守初心,致力于质谱技术在动植物生命科学和医学健康领域的研究与创新。在这个值得纪念的日子里,我们特别策划了一场“推荐有礼”活动,邀请广大科研小伙伴们共同参与,推荐您身边有组学需求的伙伴,成功签单,即可获得丰厚礼品!2024-03-13
薅羊毛 | 组学推荐,豪礼送不停时光荏苒,百趣生物已经迎来了第12个生日!我们始终坚守初心,致力于质谱技术在动植物生命科学和医学健康领域的研究与创新。在这个值得纪念的日子里,我们特别策划了一场“推荐有礼”活动,邀请广大科研小伙伴们共同参与,推荐您身边有组学需求的伙伴,成功签单,即可获得丰厚礼品!2024-03-13 -
 第37期代谢组学暨多元变量统计分析培训班由上海阿趣生物科技有限公司、Sartorius Stedim Data Analytics AB(简称Sartorius Stedim)联合主办,上海百趣代谢组学技术研究中心承办的“阿趣课堂第37期代谢组学暨多元变量统计分析培训”课程将于2024年04月20日-25日在上海举办。2024-03-13
第37期代谢组学暨多元变量统计分析培训班由上海阿趣生物科技有限公司、Sartorius Stedim Data Analytics AB(简称Sartorius Stedim)联合主办,上海百趣代谢组学技术研究中心承办的“阿趣课堂第37期代谢组学暨多元变量统计分析培训”课程将于2024年04月20日-25日在上海举办。2024-03-13 -
 新品发布 | 全面聚焦,探索一碳代谢新可能一碳代谢通路检测能精准定量生物体叶酸、四氢叶酸等代谢物浓度,为推动妇幼相关疾病研究及LDT转化提供新视角和新可能~2024-03-05
新品发布 | 全面聚焦,探索一碳代谢新可能一碳代谢通路检测能精准定量生物体叶酸、四氢叶酸等代谢物浓度,为推动妇幼相关疾病研究及LDT转化提供新视角和新可能~2024-03-05 -
 新品发布 | 直达CNS, 植需NGM尽管植物代谢组学数据的复杂,但为了解决“多”和“准”的核心需求,小趣特为植物领域工作者推出开工BUFF--植物NGM系列产品。2024-03-01
新品发布 | 直达CNS, 植需NGM尽管植物代谢组学数据的复杂,但为了解决“多”和“准”的核心需求,小趣特为植物领域工作者推出开工BUFF--植物NGM系列产品。2024-03-01 -
 项目文章(IF=27.5) | RIN基因新发现:通过根际分泌物塑造抑菌微生态,提升植物免疫力本研究发现植物发育基因可以通过对植物根系分泌物和微生物组组装的影响来控制微生物组介导的抗病性,从而使植物能够利用微生物组编码的基因和功能。2024-03-01
项目文章(IF=27.5) | RIN基因新发现:通过根际分泌物塑造抑菌微生态,提升植物免疫力本研究发现植物发育基因可以通过对植物根系分泌物和微生物组组装的影响来控制微生物组介导的抗病性,从而使植物能够利用微生物组编码的基因和功能。2024-03-01 -
 Cell | CUHK于君团队最新研究成果,除了幽门螺旋杆菌,还有你不知道的胃癌致病因子?胃癌(Gastric cancer, GC)是全球第五大常见癌症,也是导致癌症死亡的主要原因。幽门螺杆菌(Helicobacter pylori, H. pylori)是胃癌的主要危险因素,被列为I型致癌物。2024-02-05
Cell | CUHK于君团队最新研究成果,除了幽门螺旋杆菌,还有你不知道的胃癌致病因子?胃癌(Gastric cancer, GC)是全球第五大常见癌症,也是导致癌症死亡的主要原因。幽门螺杆菌(Helicobacter pylori, H. pylori)是胃癌的主要危险因素,被列为I型致癌物。2024-02-05 -
 百趣生物院士专家工作站——邓春晖教授签约仪式顺利举行2024年1月18日,上海百趣生物院士专家工作站一邓春晖教授签约仪式在上海百趣生物医学科技有限公司(以下简称百趣生物)总部顺利举行。复旦大学邓春晖教授、百趣生物CEO邓军亮等出席签约仪式。2024-01-22
百趣生物院士专家工作站——邓春晖教授签约仪式顺利举行2024年1月18日,上海百趣生物院士专家工作站一邓春晖教授签约仪式在上海百趣生物医学科技有限公司(以下简称百趣生物)总部顺利举行。复旦大学邓春晖教授、百趣生物CEO邓军亮等出席签约仪式。2024-01-22 -
 项目文章 | 蛋白质组学:看蚕豆-小麦间作系统如何击败尖孢镰刀菌与苯甲酸的威胁蚕豆(Vicia faba L.)是中国西南地区最重要的豆科作物之一。但长期单作,会导致蚕豆枯萎病发病率升高,产量和品质下降。已有研究表明,蚕豆与小麦间作可有效缓解蚕豆的自毒作用,抑制蚕豆枯萎病的发生。2024-01-18
项目文章 | 蛋白质组学:看蚕豆-小麦间作系统如何击败尖孢镰刀菌与苯甲酸的威胁蚕豆(Vicia faba L.)是中国西南地区最重要的豆科作物之一。但长期单作,会导致蚕豆枯萎病发病率升高,产量和品质下降。已有研究表明,蚕豆与小麦间作可有效缓解蚕豆的自毒作用,抑制蚕豆枯萎病的发生。2024-01-18 -
 百趣助力乳腺癌亚型新解析,开启乳腺癌治疗新篇章!百趣提供技术服务:非靶标代谢组+脂质组学2023-11-21
百趣助力乳腺癌亚型新解析,开启乳腺癌治疗新篇章!百趣提供技术服务:非靶标代谢组+脂质组学2023-11-21








