实时荧光定量PCR(real-time fluorescence quantitative PCR,qPCR)是指利用荧光信号的变化实时监测PCR(变性-退火-延伸)反应体系中每一个循环扩增产物的变化,通过Ct值或Ct值与标准曲线的关系,最终对起始模板进行精确的定量分析。该技术主要用于研究基因表达水平的检测。
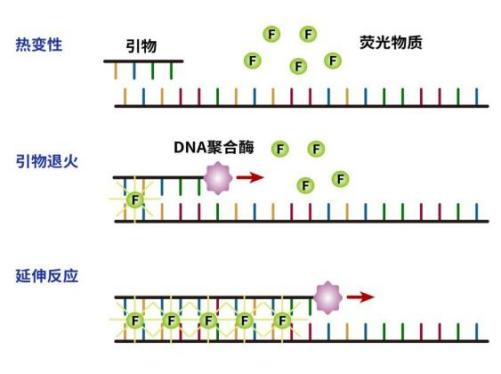

图2. TaqMan探针法
根据荧光化学原理将qPCR分为SYBR Green I染料法和TaqMan探针法,前者相对简单、成本也略低一些。TaqMan探针法,需要设计合成探针引物,成本高,但特异性、准确度也提高。一般医疗检验使用TaqMan探针法(新冠病毒检测的金标准),用于科学研究两种方法均可,各有优势。
根据qPCR定量方法进行分类:绝对定量 / 相对定量。绝对定量需要作标准曲线,最终的结果表示每例样本中基因具体有多少拷贝数。而相对定量仅能表明A样本和B样本中基因表达水平相差了多少倍。病毒拷贝数、转基因拷贝数的检测使用绝对定量;基因表达差异比较选择相对定量。
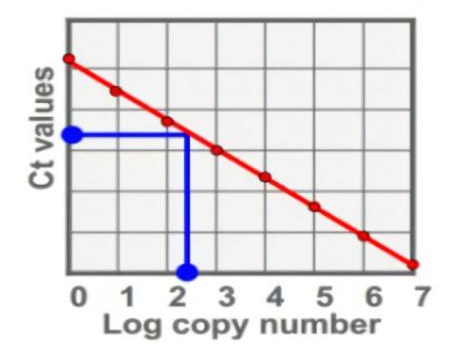
图3. 绝对定量
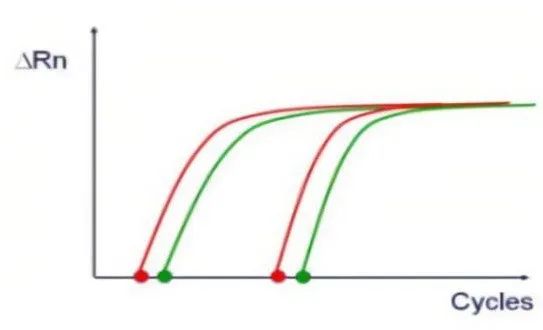
图4. 相对定量
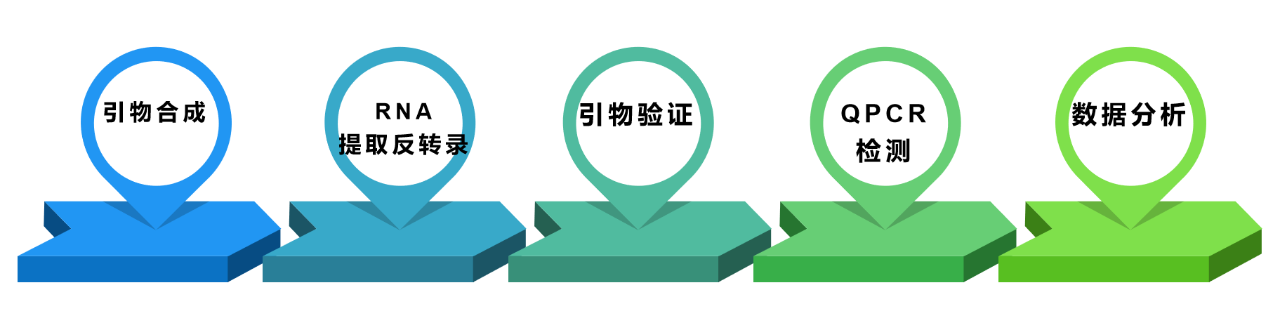
假如我们需要检测A基因在RNA水平的表达量,可参考下面的基本流程:
qPCR检测应用
特异性引物是qPCR检测结果准确与否的关键。引物设计原则:
(1)GC含量在40%~60%之间;
(2)Tm值60℃左右,上下游引物Tm值相差最好不超过2℃;
(3)扩增产物长度在80-150bp之间最佳;
(4)避免出现二级结构和非特异性扩增;
(5)引物尽可能设计在基因的转录本共有外显子上。
通常一个引物设计好后还需要 Blast进行引物特异性验证(NCBI数据库Primer Blast)。
另外,给大家推荐几个引物设计软件;Primer3 plus、PrimerPremier、NCBI等,也可在PrimerBank、ICG、qPrimerDB - qPCR Primer Database搜索引物序列。
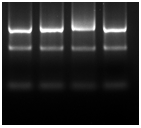
一般使用TRizol法提取RNA,提取后的RNA在质控后进行反转录。RNA的质量主要从两个方面评估:纯度/完整性。纯度可在RNA提取后通过OD260/OD280比值得知,OD值在1.9-2.0之间,纯度高。RNA完整性通过琼脂糖凝胶电泳检测,电泳后明显看到28S、18S条带,且28S的条带亮度是18S的2倍左右,说明RNA完整性好。RNA样本为了避免反复冻融,建议大家尽快安排反转录。
注意:在RNA的提取过程中要特别注意RNA酶的污染。在独立的空间进行提取,且全程使用无RNA酶的试剂耗材。可对使用的枪头、EP管进行灭菌、烘干处理,使用的相关试剂可以使用DEPC水配置。
qPCR引物除了在设计时进行Blast特异性检测,后续还需要进行预实验验证。qPCR预实验结束后进行电泳,条带位置正确、且泳道中没有杂带,Ct值在正常范围内,且熔解曲线单峰,评估PCR实验体系的扩增效率。
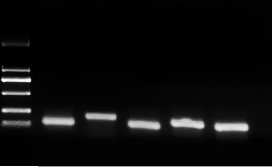
图6. qPCR引物电泳结果
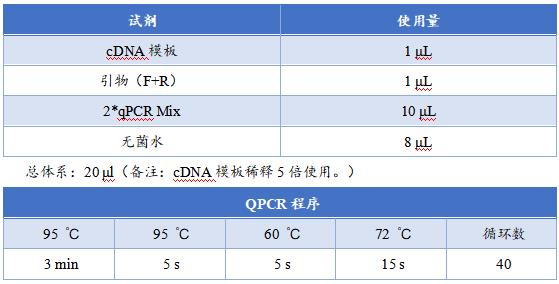
qPCR条件优化后可以准备正式实验了。由于 qPCR灵敏度高,所以每个样品/基因至少要做3个平行孔,以防在后面的数据分析中,由于Ct相差较多或者SD太大,无法进行统计分析。
qPCR的扩增曲线是光滑的“S”型,分为基线期、扩增期(指数 / 线性)、平台期。熔解曲线单峰,熔解曲线分析可以用来确定不同的反应产物,包括非特异性产物,出现多峰显示PCR扩增出了多个产物。

图7. 扩增曲线
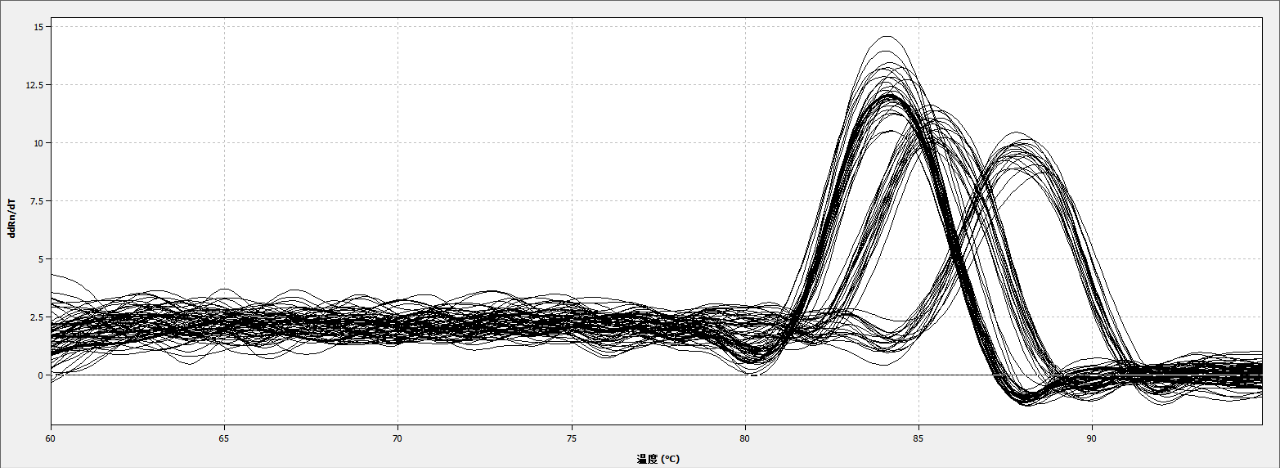
图8. 溶解曲线
基线:在qPCR扩增反应最初的数个循环中,荧光信号变化不大,近似一条直线,称之为基线。
荧光阈值:一般将qPCR反应前15个循环的荧光信号作为荧光本底信号,荧光阈值是3-15个循环荧光信号标准差的10倍,荧光阈值设定在qPCR扩增的指数期。
Ct值:是指扩增产物的荧光信号进入指数扩增期时所需要的循环数,Ct值与起始拷贝数的对数存在线性关系,起始拷贝数越多,Ct值越小。
熔解曲线:指随温度升高,双链扩增产物逐渐解链,导致荧光强度下降,到达某一温度,大量产物解链,荧光信号急剧下降,将此温度称之为Tm值,不同的PCR产物Tm值不同,从而可对qPCR的特异性进行鉴定。
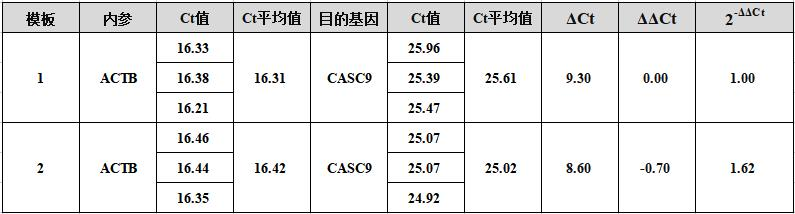
qPCR数据分析普遍采用操作简便的2–ΔΔCT法。对所有检测样本,用内参基因的Ct值归一目标基因的Ct值。设置A2为1号样本目标基因的Ct值,A1为1号样本内参基因的Ct值,B2为2号样本目标基因的Ct值,B1为2号样本内参基因的Ct值,2号样本中目标基因的表达水平是1号样本目标基因的表达水平的2–ΔΔCT倍。
ΔΔCT=(A2 - A1)-(B2 - B1)
相信通过以上介绍,各位老师对WB实验有了一定的了解, 同时百趣生物也提供qPCR检测服务。如果您想了解更多内容或需求请致电:400-664-9912