
发表期刊:Frontiers in Pharmacology
发表时间:2022.5
影响因子:5.988
合作单位:中南大学湘雅医院
百趣生物提供服务:TMT标记蛋白组
Profilin 1(PFN1)是一种肌动蛋白结合蛋白,在几种癌症的转移中发挥着不同的作用;然而,其在非小细胞肺癌(NSCLC)转移中的作用仍不清楚。作者应用TMT标记定量蛋白组技术研究其诱导肿瘤转移的机制。蛋白质组学分析显示PFN1参与微泡(MV)分泌。与非转移性NSCLC患者的血清相比,转移性NSCLC患者的血清中MV的丰度增加。体外和体内实验均表明,PFN1可以增加MV分泌,并且源自PFN1过表达细胞的MV显著促进NSCLC转移。同样发现PFN1可以与ROCK1相互作用并增强其激酶活性以促进肌球蛋白轻链(MLC)磷酸化从而促进MV分泌。ROCK1的抑制降低了MV的分泌并部分逆转了PFN1诱导的NSCLC转移的促进作用。总的来说,这些发现表明PFN1调节MV分泌以促进NSCLC转移。PFN1和MV代表了NSCLC转移的潜在预测因子或治疗靶点。
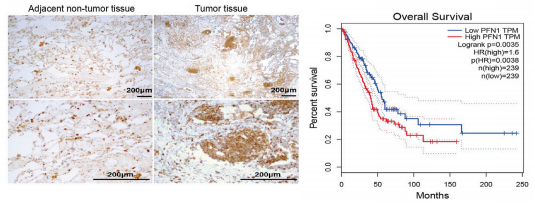
为了研究PFN1在NSCLC中的作用,作者采用IHC方法、组织芯片定量等实验,表明了PFN1参与了NSCLC的转移,并构建细胞系,通过RT-qPCR和Western检测过表达和敲除的影响,后又采用伤口愈合和Transwell迁移试验来确定PFN1对迁移的影响。
为了进一步研究EV和PFN1 OE细胞之间的分子差异以及影响NSCLC的可能信号通路。作者利用基于蛋白质组学的方法(TMT定量蛋白质组学)描述它们之间的蛋白质水平。差异蛋白质(DEPs)筛选条件为P值<0.05和倍数变化≤0.83或倍数变化≥1.2。结果确定了581个差异蛋白质,其中327个上调的蛋白质和254个下调的蛋白质(图2)。
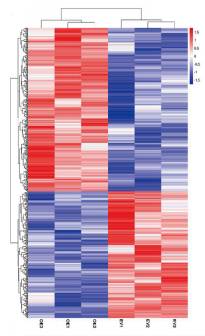
图2. 差异表达蛋白分析热图
接下来,利用富集分析来确定这些DEPs是否可以指向任何特定的生物学功能,从而可以深入了解它们在生物学功能上的差异。GO注释表明DEPs涉及蛋白质结合、细胞成分组织或生物发生和细胞器组织(图3)。大多数不同表达的蛋白与细胞器相关,这与PFN1在细胞膜运输中的作用相一致。同源蛋白群簇(COG/KOG)分析显示,DEPs参与了翻译后修饰、蛋白质转换、伴侣蛋白、细胞内运输、分泌、囊泡转运和信号转导机制(图4)。通过蛋白质组学分析,我们推断PFN1可能通过蛋白相互作用和信号转导参与细胞外囊泡分泌,进而促进NSCLC转移。
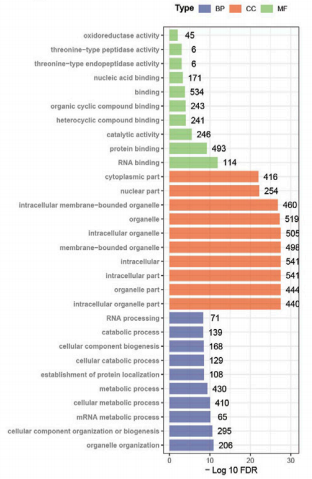
图3. 差异表达蛋白的GO富集分析
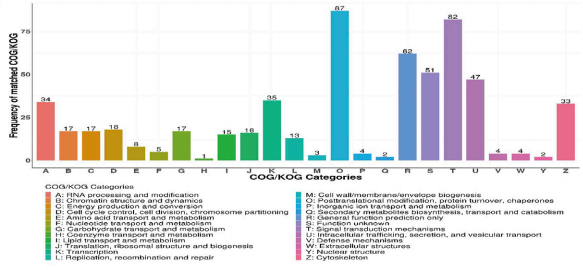
图4. 差异表达蛋白的COG/KOG分析
由于PFN1在细胞膜运输中起着重要作用,而MVs是癌症转移的关键介质,我们从临床样本的血清中提取了细胞外囊泡(MVs和外泌体)。通过一系列实验,发现PFN1可能调控MLC的磷酸化,而磷酸化可以调节MV的分泌。
Mv是癌症转移的关键介质。作者收集了转移性(n=25)和非转移性(n=20)肺癌患者的血清样本,并提取了Mv(图5)。作者通过一系列过表达,以及伤口愈合和Transwell迁移实验,发现PFN1可能通过诱导MV分泌促进NSCLC转移。
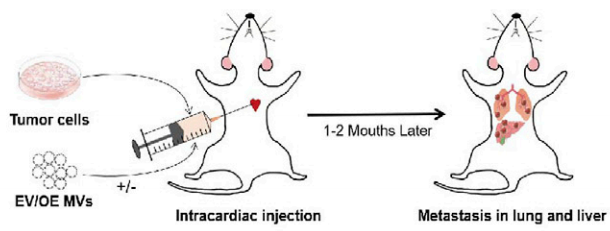
图5. 为确定PFN1在肿瘤转移中的作用而建立的转移瘤小鼠模型示意图
为了进一步研究PFN1在NSCLC转移中的作用,我们通过心内注射H1299NSCLC细胞建立了肿瘤转移的小鼠模型,结果进一步证实了PFN1在NSCLC转移中的作用(图6)。
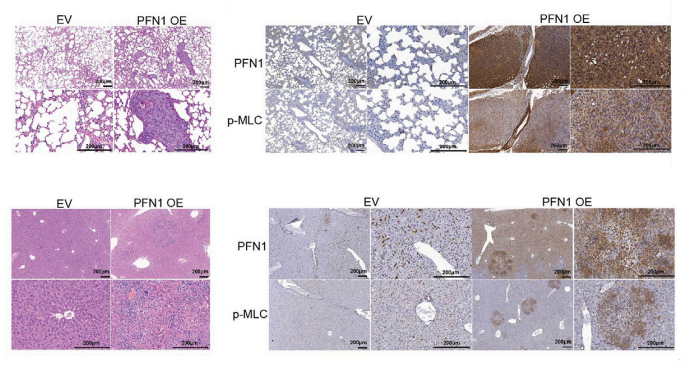
图6. HE染色小鼠模型肺组织的代表性图像/肺组织中PFN1和p-MLC表达的代表性IHC图像
作者通过敲低、过表达、co-IP、Western blot、免疫荧光、流式细胞术等实验,发现PFN1可以与ROCK1相互作用,增强其激酶活性,并间接促进MLC磷酸化,最终诱导MV分泌。ROCK1抑制剂Y27632部分逆转了PFN1促进MLC磷酸化和MV分泌的作用(图7)。
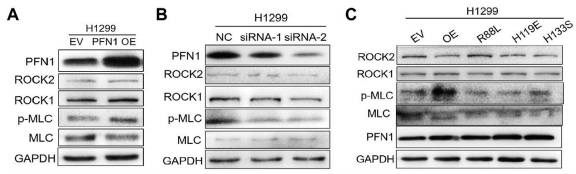
图7. western印迹法测定PFN1过度表达(A)/敲除(B)后的蛋白表达/PFN1突变体中的蛋白表达(c)
创面愈合实验显示(图8),Y27632处理的过表达PFN1的细胞迁移减少到接近EV细胞.接下来,将过表达PFN1的细胞来源的MVs添加到y27632处理的细胞中,发现Y27632并没有逆转过表达PFN1的细胞来源的MVs诱导的迁移,从Transwell迁移实验中也得到了类似的结果,此外也用小鼠模型验证了这些结果。

图8. 伤口愈合实验评估Y27632的疗效
研究结果表明,PFN1是关键的肌动蛋白调节蛋白,调控肌动蛋白细胞骨架的关键蛋白之一,它通过ROCK/p-MLC通路促进MV的释放,从而促进NSCLC的转移。因此,PFN1可能是NSCLC转移的潜在治疗靶点。通过减少MVs的释放,有可能会部分逆转PFN1过表达诱导的NSCLC细胞迁移。本研究为靶向转移治疗NSCLC提供了一种潜在的新方法,值得进一步研究。
文献下载链接:
https://pan.baidu.com/s/1Jda9RxpoO-pJxy_8xUTN5w
提取码:0000









