
文章标题:Unravelling the enhanced vaccine immunity by heterologous KCONVAC/Ad5-nCoV COVID-19 vaccination
发表期刊:Signal Transduction and Targeted Therapy
影响因子:38.104
作者单位:中国药科大学
自2019年12月以来,新型冠状病毒肺炎(Corona Virus Disease 2019,COVID-19),简称“新冠肺炎”的出现,影响着世界不同国家不同地区的人类健康。目前除了做好个人防护之外,有效应对COIV-19的方式之一是进行新冠疫苗接种。截至2022年3月,中国已经向120多个国家和国际组织提供了超过21亿剂疫苗,占中国以外全球疫苗使用总量的1/3。越来越多的证据表明,与同源疫苗相比,异种新冠肺炎疫苗能产生更高的抗体和细胞免疫应答,但对增强疫苗免疫的免疫学机制尚缺乏基本了解。为了获得机理上的见解,中国药科大学林昂研究员团队采用蛋白质组学、转录组学等多组学的方法全面开展了同源或异源加强免疫在小鼠身上产生免疫反应的机理研究。2022年8月研究成果成功发表在影响因子:38.104的《Signal Transduction and Targeted Therapy》期刊上。
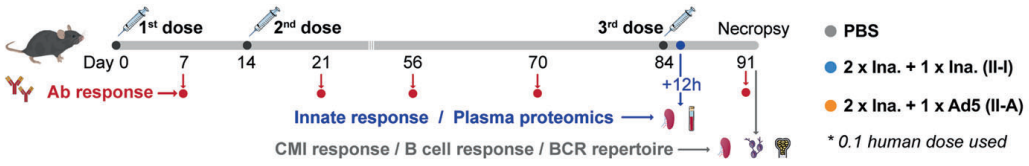
图1. 实验设计总图概览
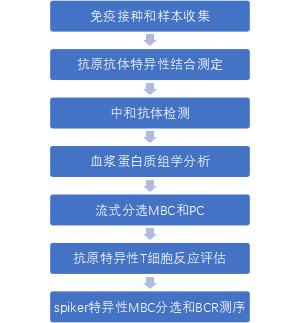
作者用两剂灭活疫苗(KCONVAC, 深圳康泰)肌肉注射免疫C57BL/6小鼠,间隔2周,然后在第12周用同源或异种Ad5-nCoV接种免疫。无论疫苗类型如何,第三针均可进一步刺激免疫球蛋白应答,而异源加强免疫诱导的免疫球蛋白滴度显著高于同源对照。免疫后7d,同种免疫组和异种免疫组的抗Spike-抗体几何平均滴度(GMTs)分别为11,404和229,880。有趣的是,Ad5-nCoV免疫诱导了适度的抗Spike IgA反应(图1,a),这为异源疫苗策略提供了额外的优势。针对SARS-CoV-2野毒株的中和抗体水平在异源加强免疫上显著提高,并显示出比同源加强免疫诱导的水平高20倍(图1,b)。重要的是,中和抗体检测显示,异源加强免疫对Delta(B.1.617.2)和Omicron(B.1.1.529)变异体诱导了显著更高的中和抗体水平。
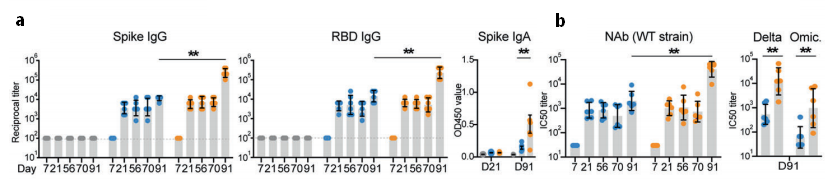
图2. 增强剂免疫接种后的免疫增强结果图
早期的先天免疫激活形成了适应性疫苗免疫。因此,作者评估了免疫后12小时的先天反应。在异源加强免疫作用下,CD86在来自脾的cDC1和来自血液和脾的cDC2上显著上调,这在同源加强免疫组中未见。此反应可能归因于载体的自身免疫效应,因为腺病毒载体本身可以触发参与先天激活的多个信号通路。采用TMT定量蛋白组学(由百趣生物提供)对同源或异源增强后接种小鼠血浆进行了研究分析。所有定量蛋白质的主成分分析(PCA)显示了三组之间的不同分布(图2,a)。对差异表达蛋白质展开分析显示,异源加强免疫显著改变了血浆蛋白质图谱,与PBS处理的小鼠相比,119和31个蛋白质的水平分别至少增加或降低了2倍。相反,接受同源加强免疫的小鼠的血浆蛋白水平与PBS处理的小鼠基本相似(图2,b)。进一步分析表明,异源启动子上显著变化的蛋白质高度参与炎症反应、抗原摄取/处理和I型干扰素应答,并且接受异源加强免疫的小鼠明显高表达(图2,c)。有趣的是,同种和异源加强免疫都能诱导中性粒细胞的强烈激活,表现为髓过氧化物酶、中性粒细胞激动素、中性粒细胞蛋白和五肽相关蛋白3等颗粒的释放。脾中性粒细胞也被激活,表现为CD40和CD86的表达增加(图2,d)。
图3. 蛋白组学数据分析结果图
Th1型细胞免疫是控制SARS CoV-2感染的关键。尤其是铝接种灭活疫苗更容易引发Th2型免疫。正如作者研究所显示的那样,三剂KCONVAC刺激了大量分泌IL-4的CD4+T细胞(图4,a)。六只小鼠中只有三只产生IFN-γ或IL-2的特异性cd4+T细胞。异源加强免疫诱导后,分泌TNF-或IL-2的CD4+T细胞量显著升高,而分泌IL-4的T细胞与同源加强免疫诱导的水平相当。较高比例的Spike-特异性的CD4+T细胞产生两种以上类型的Th1型细胞因子,表明T细胞具有多功能性(图4,b)。轻度诱导分泌IL-21的CD4+T细胞,提示T滤泡辅助细胞反应的产生。这些结果表明,接种两剂KCONVAC后的Ad5-nCoV接种可诱导出平衡的Th1/Th2疫苗应答。
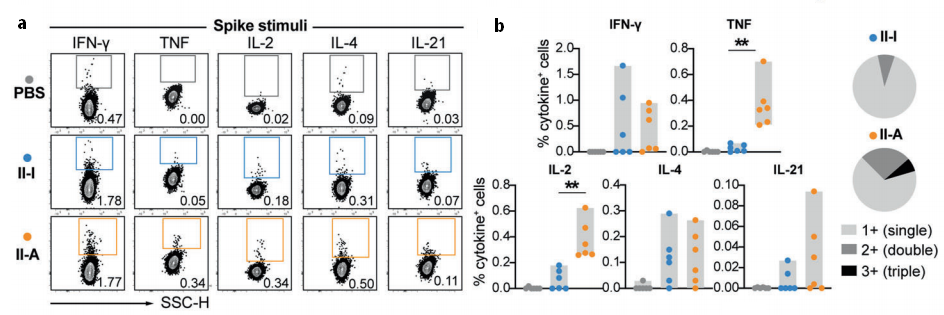
图4. 流式细胞仪检测T细胞分泌因子结果
异源加强免疫引起的增强抗体应答可能归因于强大的生发中心(GC)反应(生发中心(GC)反应:针对外来病原体的T依赖性体液免疫的基础,也是适应性免疫反应的最终表达)。为了研究这个问题,作者接着分析了脾、淋巴结(LN)引流注射部位和骨髓(图5,a)。异源加强免疫在所有三个淋巴器官中诱导了显著更高的类别切换的Spike+MBCs(记忆B细胞)和Spike+PC水平(浆细胞)(图5,b)。SHM是GC反应过程中的一个关键过程,决定了抗体亲和力的成熟和克隆的多样性。为了评估这一点,研究人员从脾中分离出CD19+IGD-IgM-Spike+MBCs,并进行BCR(B细胞受体)测序。由于细胞量有限,每组分选的MBCs被混合在一起进行分析。异源加强免疫产生了更多样化的BCR克隆,这可能是由于IGHV和IGHJ基因的较高突变率引起的(图5,c)。CDR3在V和J基因片段上都显示出更高的突变数量,并伴随着长度的增加。对IGHV-IGHJ基因片段的配对使用也进行了评估。在同源加强免疫组中,仅使用有限数量的重链V和J基因,其中IGHV1-26-IGHJ3和IGHV1-26-IGHJ4是使用频率最高的两对基因。相反,异源加强免疫产生的BCR表现出高度多样化和广泛的V-J基因配对使用,其中IGHV1-12-IGHJ4、IGHV2-9-1-IGHJ4、IGHV9-3IGHJ1是使用最多的三个基因对。对每组疫苗组中前100名主要BCR克隆进行鉴定,发现在接受异源加强免疫的小鼠中观察到BCR克隆显著增加的优势 (图5,d)。同时也测定了Ig kappa(κ)和lambda(λ)l轻链的序列。在免疫球蛋白λ谱系中,同源和异源加强免疫组中使用频率最高的一对分别占V-J用法的98.4%和99.1%。而对于Igκ谱系,异源加强免疫产生的V-J基因使用范围更广,其中IGKV6-15IGKJ1使用频率最高。相反,由同源加强免疫剂引发的BCE谱主要使用IGKV3-1-IGKJ1,配对(图5,e)。这些数据表明,带有Ad5-nCoV的异源加强免疫能更有效地诱导出不同的Spike特异性抗体克隆,并具有更高的SHM率,这与增强的抗病毒抗体应答有关。
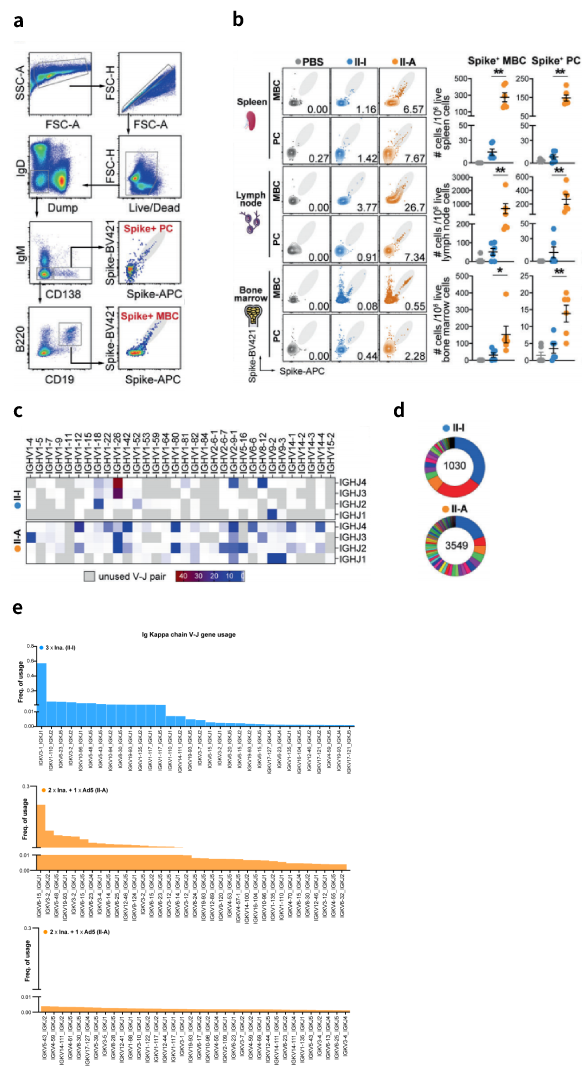
图6. 异源加强免疫引起的增强抗体应答GC研究以及测序结果分析
临床数据表明,异种新冠肺炎疫苗加强免疫比同源加强免疫更具优势,不仅诱导更高的抗体应答,而且更有效地保护机体。利用小鼠模型,对同源或异源加强免疫引发、产生和维持疫苗应答的多个方面进行了较为全面的研究,从机理上解释了异种增强剂增强疫苗免疫的一些关键问题。
本次研究的局限性之一是,由于所使用的动物模型和技术限制,作者没有对天然激活和产生高质量抗体反应和异源加强免疫引起的GC反应之间的相关性进行深入剖析。然而,人们普遍认为,通过使用最佳免疫来突破天然免疫系统是一种很有前途的策略,可以用于下一代新冠肺炎疫苗的开发。因此,针对不断出现的SARSCoV-2变异株和迅速减弱的免疫力,两剂灭活疫苗的接种和腺病毒载体疫苗接种的结合可能有望应对这一挑战。
文献下载链接:
https://pan.baidu.com/s/1kvJ9mf_skps3ta9yqVD0Qg
提取码:0000









