

文章标题:Radiogenomic-based multiomic analysis reveals imaging intratumor heterogeneity phenotypes and therapeutic targets
发表期刊:Science Advances
发表时间:2023年10月
影响因子:13.6
合作单位:复旦大学附属肿瘤医院
百趣提供技术服务:非靶标代谢组学+经典脂质组学
众所周知,对于同一类型的乳腺癌,不同患者的乳腺肿瘤各不相同,需要不同的治疗方法,即肿瘤间异质性。即使同一患者的同一乳腺肿瘤,不同部位也可能分布不同的乳腺肿瘤细胞,即肿瘤内异质性(intratumor heterogeneity, ITH)。而病理活检和病理切片只能反映活检局部和切片部分的病理特征,无法准确反映整个乳腺肿瘤的病理特征,目前已有大量证据表明ITH会导致治疗失败和疾病复发。此外,病理检查虽然是金标准,但是存在创伤性,也不太可能多次进行动态监测。因此,开发一种非创伤性和全局性的ITH识别方法至关重要。
本研究建立了大型多中心影像多组学数据库,通过提取高通量特征将影像转化为数码矩阵,进而关联分子特征和临床预后因素,开发了实现ITH“无创可视化”的新方法,系统揭示了影像多组学肿瘤内异质性的预后价值和生物学本质,有望构建全面无创评估和精准靶向治疗的临床实践新模式。
本研究分为四个阶段(图1)。在第一阶段,研究者通过整理磁共振动态对比度增强成像(Dynamic contrast–enhanced magnetic resonance imaging, DCE-MRI)将肿瘤区作为感兴趣区域,并提取定量放射组学特征,建立了三个独立的放射组学队列。在第二阶段,建立了一个放射组学特征,以识别发现和验证队列中的影像肿瘤异质性(Imaging ITH, IITH)亚型,另外还评估并验证了IITH的预后能力。在第三阶段,通过将IITH与基因组肿瘤异质性和细胞形态肿瘤异质性相关联来验证多尺度异质性,以验证IITH的稳健性。在最后阶段,探讨了预后不良的高IITH患者的分子特征和潜在的治疗选择。
该研究首先利用复旦大学附属肿瘤医院(FUSCC,n=711)、美国杜克大学(DUCK,n=641)、美国癌症基因组图谱(TCGA,n=122)乳腺癌患者的动态对比增强磁共振成像和临床、病理、基因组数据(图2),建立了大型多中心乳腺癌影像多组学数据库。随后对肿瘤内影像直方图特征和纹理特征、全外显子组测序、转录组测序、拷贝数变异、代谢组学、苏木精伊红染色数字化病理图像、治疗方案和长期随访结果进行大数据分析。
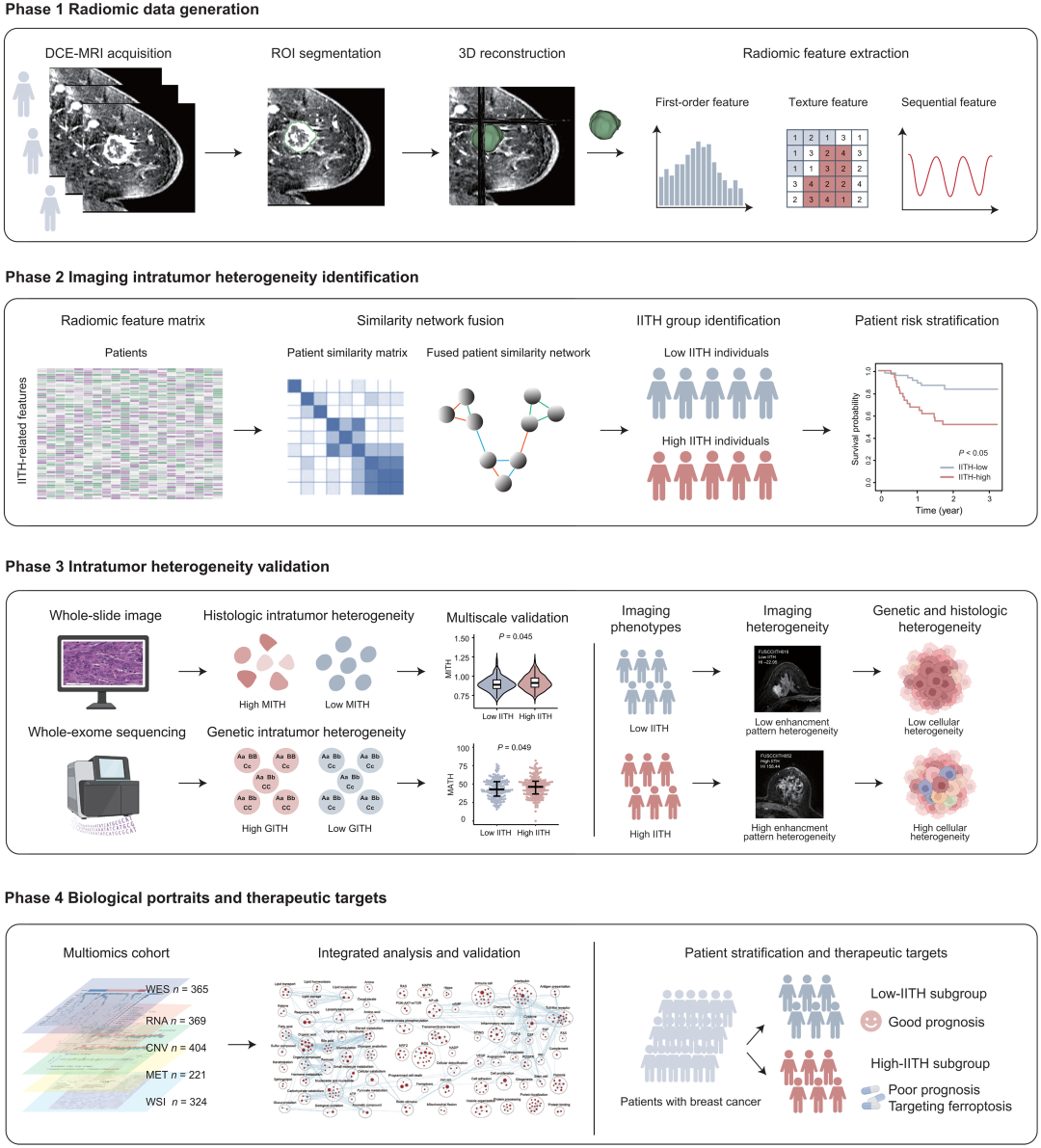
图1 研究示意图
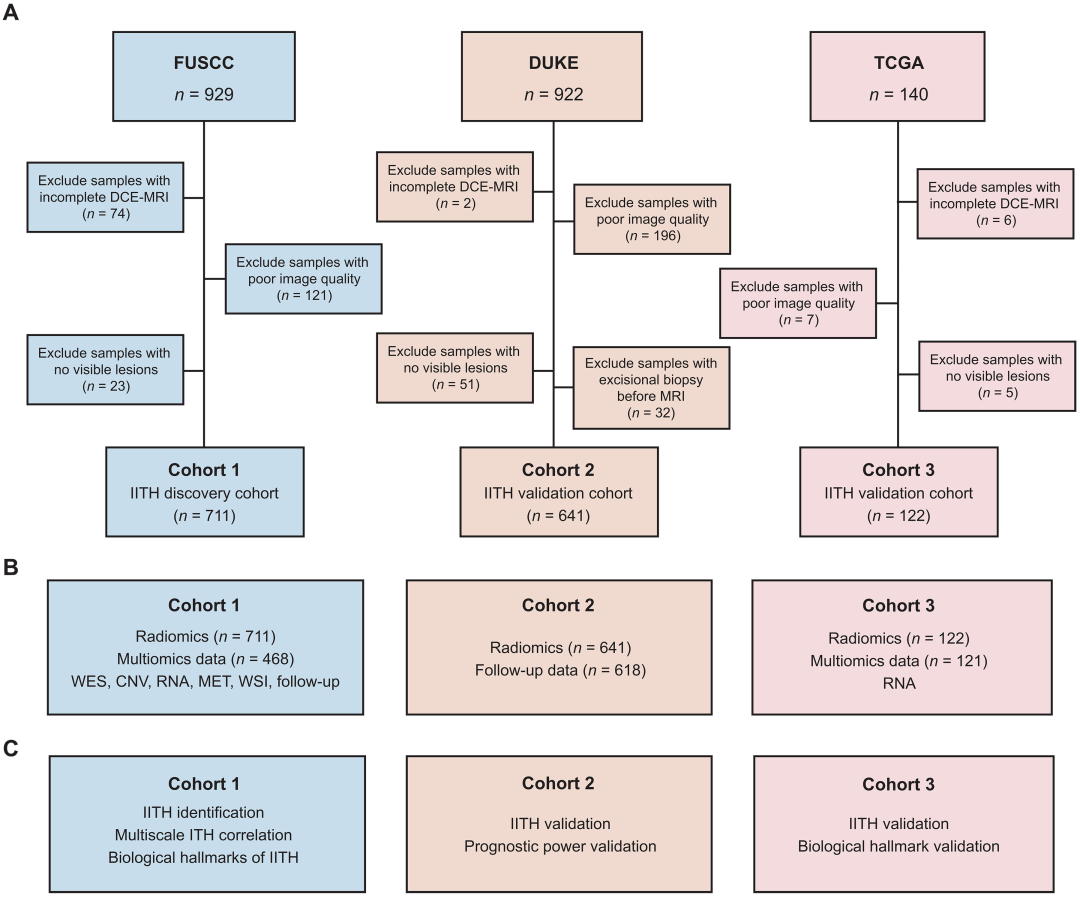
图2 队列概述
首先,研究者试图建立一个放射组学特征来评估IITH。在发现队列(FUSCC队列,n=711)中,选择203个高度可变的异质性相关特征,包括40个一阶特征和163个文本特征(影像组学图像的基本特征)分别纳入相似性网络融合(Similarity network fusion, SNF)分析,以产生两种不同的表型(图3A)。将相同的标准和过程应用于验证队列,旨在DUCK(n=641)和TCGA(n=122)数据集中识别IITH高和低的患者。并通过计算每个样本的异质性指数( heterogeneity index, HI)得分,发现更大的HI具有更大的成像异质性(图3B-D)。DCE-MRI图像表明,具有高IITH的图像表现出高度不均匀的增强模式,而低IITH样本则更加均匀(图3E-F)。总体而言,研究者开发了一种放射组学特征,以识别乳腺癌大型多中心放射组中不同的IITH状态。
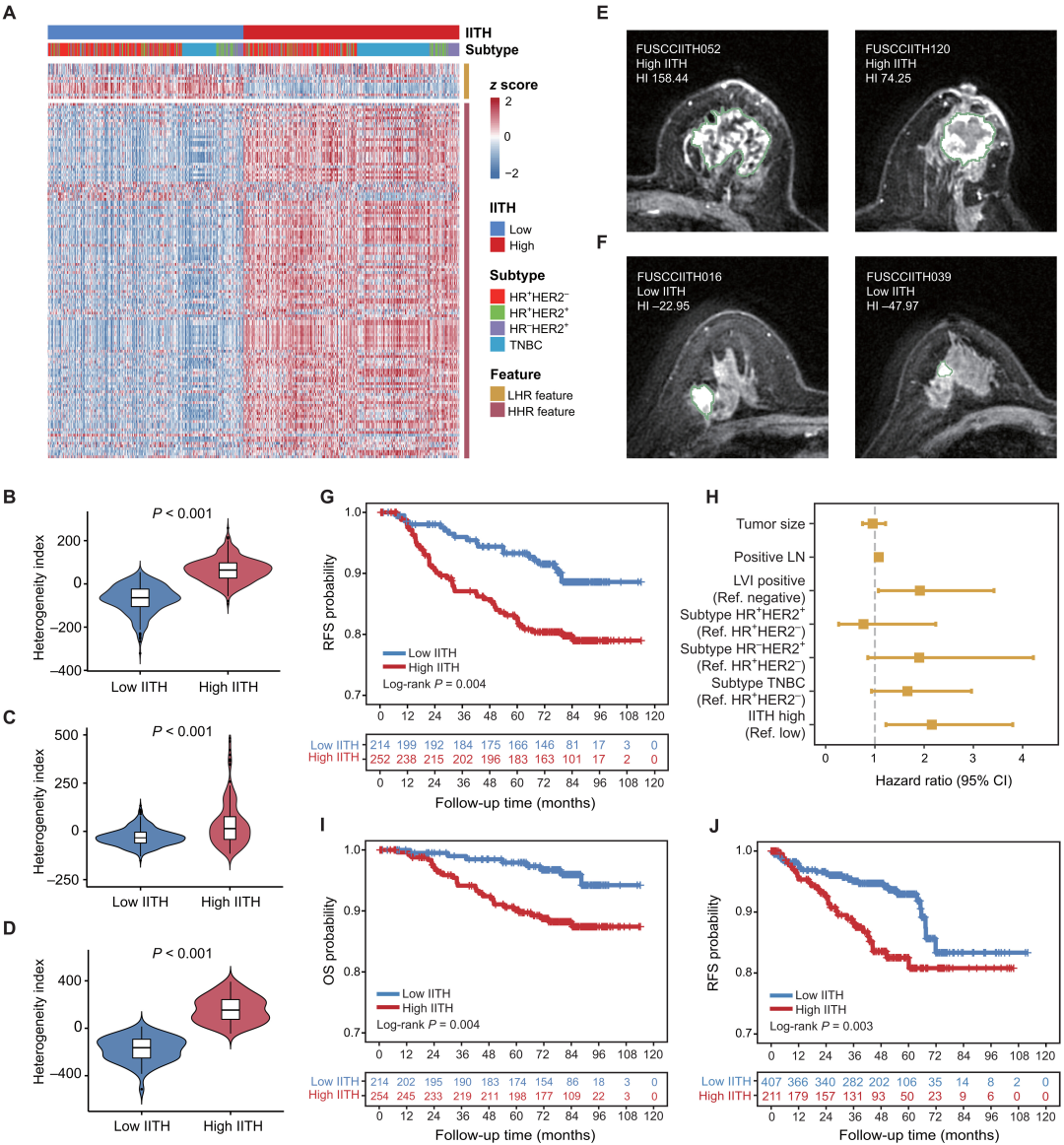
图3 癌症IITH表型的鉴定
随着发现队列的长期临床随访,研究者发现了IITH的预后价值。IITH高的患者无复发生存率(relapse-free survival, RFS)明显较差(P=0.004;图3G)。多变量Cox比例风险模型显示,在调整了众所周知的预后因素后,高IITH是一个独立的不良预后指标(图3H)。出乎意料的是,IITH也是癌症患者总生存率(overall survival, OS)的指标(P=0.004;图3I)。此外,还从外部验证了DUKE队列的预后能力。总之,研究结果揭示了IITH亚型的独立结果预测能力。
为了验证IITH的稳健性,研究者试图将表型IITH与ITH的其他评估方法进行比较,如微观基因组异质性和微观细胞形态异质性。结果表明,IITH高的患者比IITH低的患者在基因组上更具异质性(P=0.049;图4B)。此外,研究者计算了肿瘤突变负荷(tumor mutational Burden, TMB)和新抗原负荷,发现高IITH患者的TMB(P=0.005)和新抗体负荷(P=0.043)较高(图4C-D)。从H&E染色的肿瘤载玻片的全玻片图像中,研究者提取了14个形态学特征和4个纹理特征,这些特征表征了肿瘤、基质细胞和炎症细胞的细胞核。通过量化每个肿瘤样本内细胞核形态的变化来评估形态ITH(morphological ITH, MITH)。值得注意的是,高IITH肿瘤表现出细胞形态ITH(morphological ITH, MITH)升高(图4E-G)。总之,DCE-MRI衍生的IITH与基因组及病理ITH评估一致。
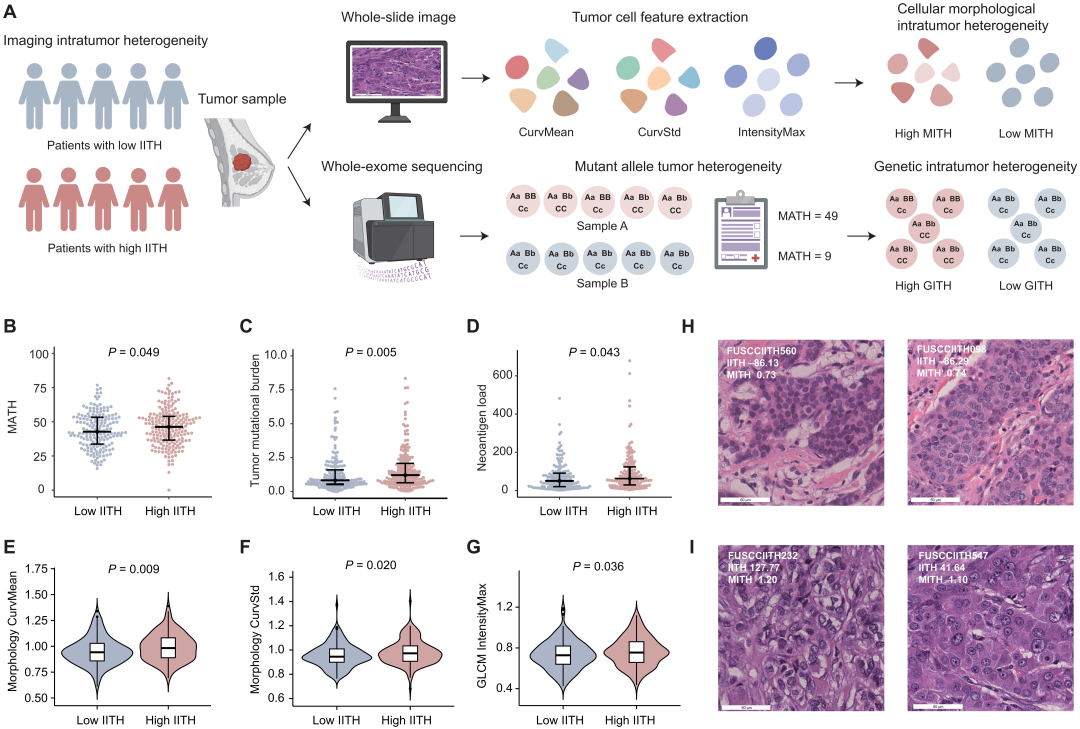
图4 IITH、基因组ITH和MITH之间的相关性
为了研究高和低IITH肿瘤之间预后差异的生物学基础,研究者进行了多组学分析,以揭示它们的分子差异。使用基因集富集分析(Gene set enrichment analysis, GSEA)来探索高IITH中的富集途径。结果表明,高IITH肿瘤表现出广泛的代谢失调,包括脂肪酸、氨基酸、有机酸、核苷和糖原的上调(图5A段)。通过归一化富集分数(Normalized enrichment score, NES)观察到铁死亡、氧化应激转录因子NRF2 (NF-E2-related factor 2, NRF2)、活性氧(reactive oxygen species, ROS)、胆汁酸代谢在高IITH肿瘤中最为活跃,而与DNA双链断裂相关的过程在低IITH肿瘤中最为活跃(图5B)。这些结果揭示了两个患者亚组的不同生物学特征,其中高IITH肿瘤面临氧化应激反应时代谢旺盛,而低IITH肿瘤缺乏明确的特征。在转录组分析揭示的富集代谢途径的基础上,研究者对高和低IITH组的代谢组学数据进行了差异丰度(Differential abundance, DA)评分分析。并在具有三种以上注释代谢物的代谢途径中鉴定了14种上调途径。具体而言,多种代谢途径,特别是脂肪酸生物合成途径在高IITH肿瘤中上调(图5C)。总之,转录组学和代谢组学分析表明,具有高成像异质性的肿瘤是癌症的一种表型,具有显著的恶性代谢失调,这使这些肿瘤细胞具有明显的缺铁倾向。
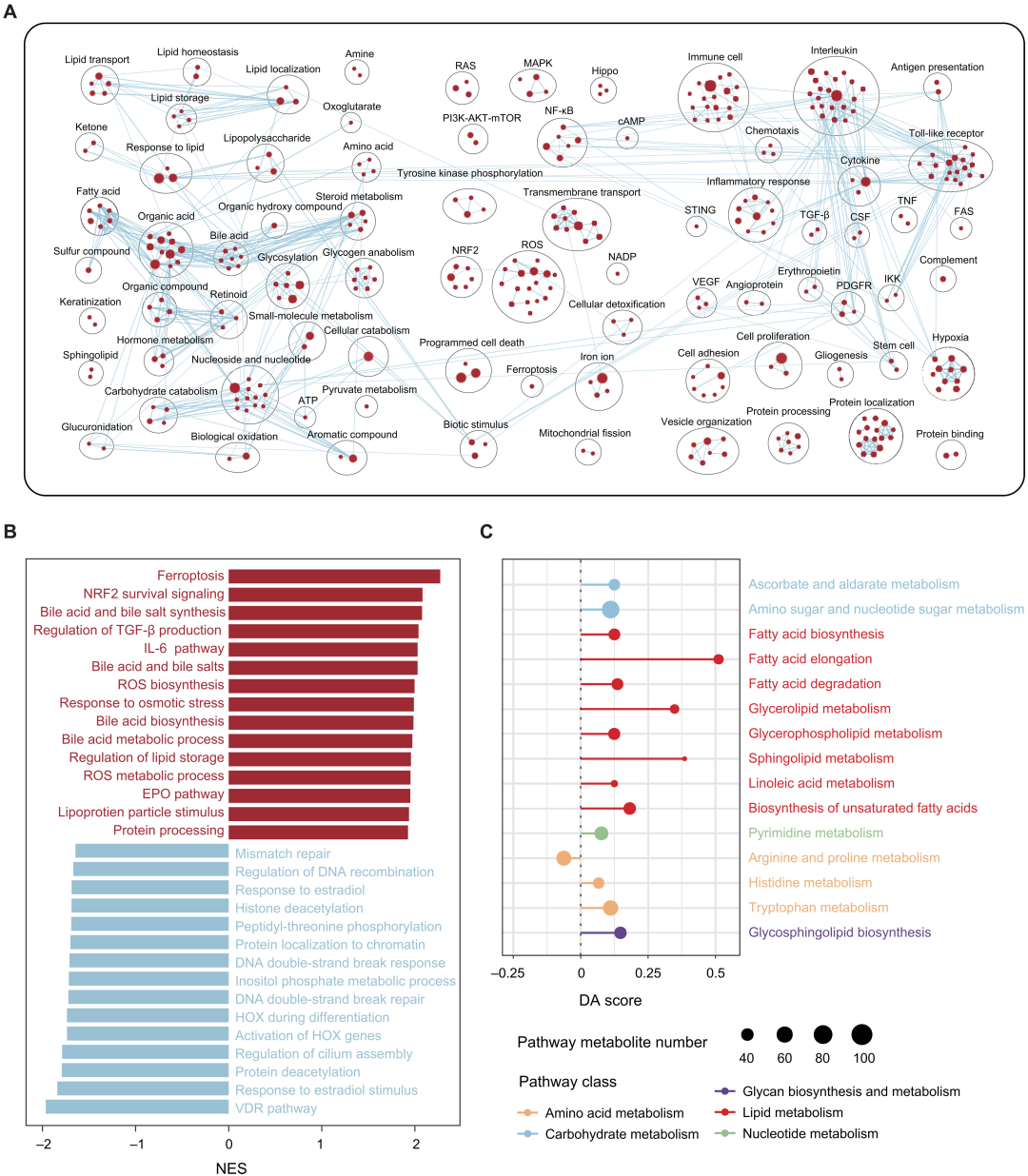
图5 高成像异质性乳腺癌的生物学特征
研究者进一步研究了转录组分析中发现的最突出的分子过程。在高IITH肿瘤的富集途径中,铁死亡排在第一位(图6A)。为了验证高IITH肿瘤中缺铁蛋白显著上调的假设,研究者进行了一项综合的多组学分析。最初,将高和低IITH样品中脂质和氧化脂质的丰度并列。综合代谢组学和脂质组学分析揭示了触发铁死亡必需的脂肪酸、磷脂酰乙醇胺和氧化脂质水平的升高(图6D)。在高IITH样本中,铁死亡等重要的生物过程,包括铁的摄入和利用、不饱和脂肪酸生物合成和过氧化物合成过程更加活跃(图6E)。这些发现表明,尽管铁蛋白缺失在具有高成像异质性的肿瘤中很明显,但作为一种自我保护策略,癌症细胞同时参与补偿机制,以阻碍程序性细胞死亡。因此,通过阻断这些抑制过程,如硫氧还蛋白途径,可以在高IITH肿瘤中诱导铁死亡。总之,通过综合分析强调了铁死亡与IITH之间的联系,并为这些预后不良的患者提出了潜在的治疗靶点。
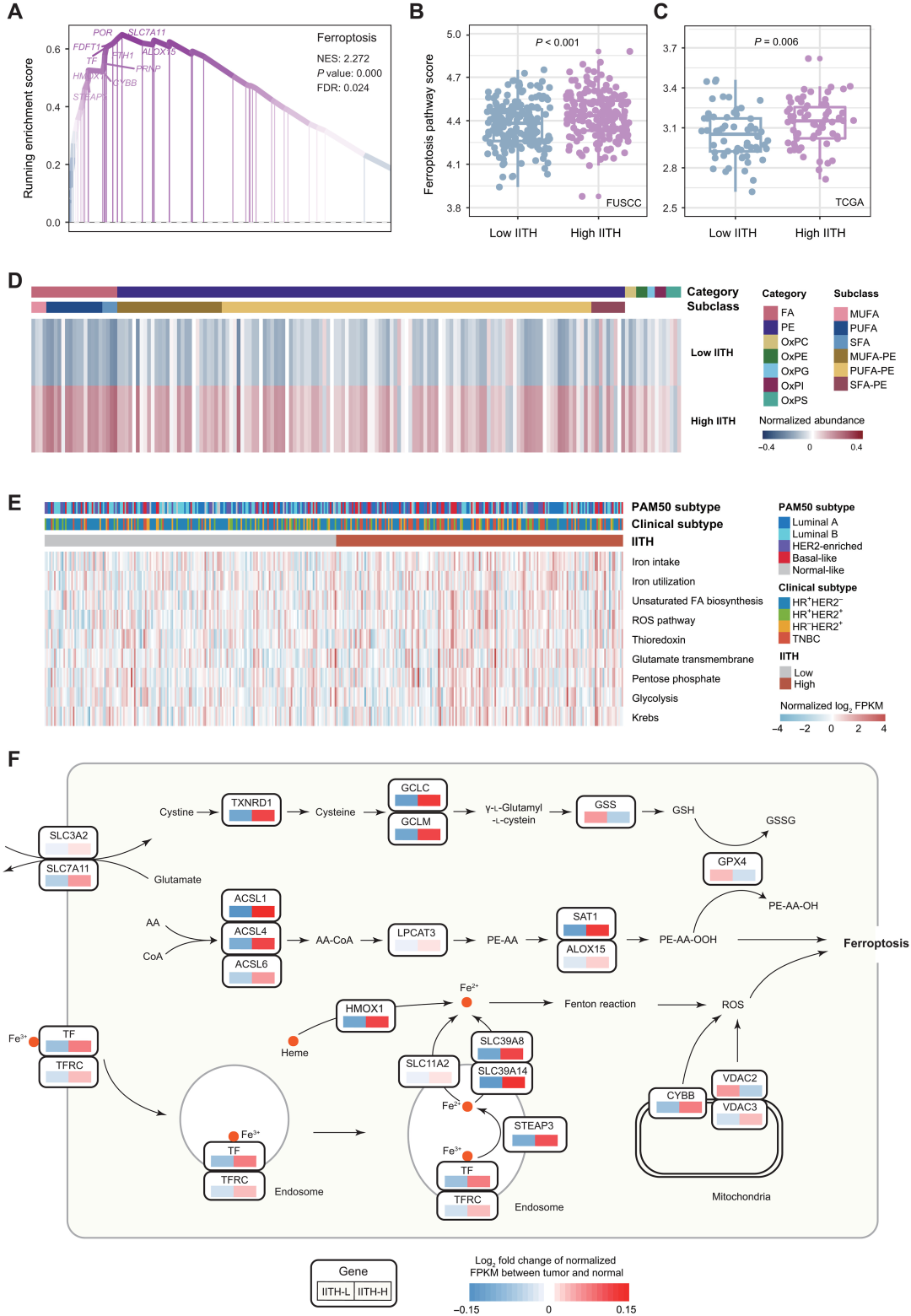
图6 铁死亡是高成像学异质性患者的一种治疗靶点
该研究利用复旦大学附属肿瘤医院711例、美国杜克大学641例、美国癌症基因组图谱122例乳腺癌患者的动态对比增强磁共振成像和临床、病理、基因组数据,建立了大型多中心乳腺癌影像多组学数据库。随后对肿瘤内影像直方图特征和纹理特征等多项结果进行大数据分析,揭示了肿瘤内影像组学异质性高的患者致癌基因通路被激活且代谢失调,并可能对铁死亡靶向治疗过程敏感。因此,该研究结果表明,根据多组学匹配的大型影像组学数据库全面解析乳腺癌患者肿瘤内影像组学异质性特征、多维度论证影像组学方法,能够可靠地分析肿瘤内异质性,并深入探索其生物学基础,为临床实践提供了肿瘤异质性无创评估和个体化精准靶向治疗策略探索的新思路。









