
文章标题:Heme-deficient primitive red blood cells induce HSPC ferroptosis by altering iron homeostasis during zebrafish embryogenesis
发表期刊:Development
影响因子:4.6
合作客户:中国科学院动物所
百趣提供技术服务:氧化脂质高通量靶标代谢组学
造血系统分为初级造血和次级造血,初级造血是在中间细胞团产生原始红细胞(red blood cells, RBCs)和髓系细胞,次级造血是通过背主动脉腹壁的内皮细胞向造血细胞转化,产生造血干细胞和祖细胞(progenitor cells, HSPCs)。研究表明原始髓系细胞在HSPCs生成过程中具有重要作用。然而,RBCs在HSPCs的形成过程中的作用是未知的。哺乳动物缺乏RBCs会导致胚胎死亡,而缺乏RBCs的斑马鱼能存活到幼虫阶段。铁稳态对红细胞生成至关重要且具有双重作用,适量的铁可以促进HSPCs分化,过量的铁会诱导红细胞脱铁。然而,铁稳态对胚胎发育的过程中的HSPCs的形成尚不清楚。因此作者利用斑马鱼为模型,探究RBCs和铁对HSPCs的影响。
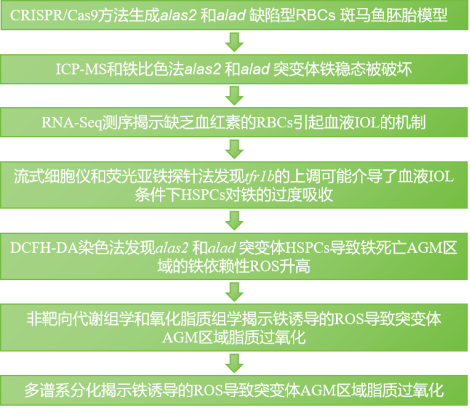
图1. 技术路线
实验结果
1. alas2或alad缺陷型斑马鱼胚胎的HSPC发育受到阻碍
缺乏RBCs模型分为RBC缺失型(缺失 tif1γ和gata1)、原始RBC低成熟型(缺乏klf1和klf3)和血红素缺乏的原始RBC型(缺失alas2或 alad)(图2 A)。使用CRISPR/Cas9诱导alas2和alad基因缺陷胚胎生成,在受精(post-fertilization, hpf)后30小时表现为无色血液表型(图2 B-C),36 hpf时,突变体中runx1和cmyb表达量均明显降低(图2 D-I),突变体的AGM区域的kdrl+/cmyb+ HSPCs的数量也显著减少(图2 J-K)。
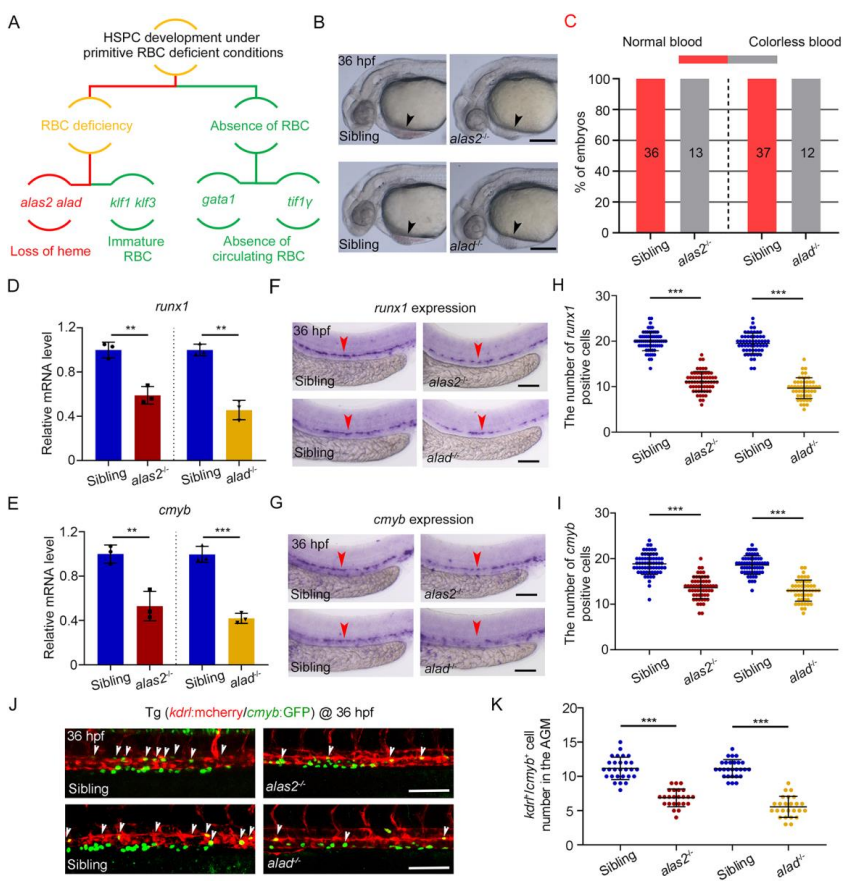
图2. alas2和alad基因缺陷胚胎的HSPC形成受阻
2. 铁在缺乏血红素的原始红细胞中积累
血红素合成酶alas2和alad的编码基因在原始RBCs中特异性表达,36 hpf时,alas2和alad的缺失会导致血红素代谢异常,造成血红蛋白缺乏症。电感耦合等离子体质谱法(ICP-MS,百趣生物提供检测服务)和铁比色法试剂盒测定斑马鱼身体和卵黄区的铁含量(图3 A)。两种突变体卵黄区的铁含量都明显降低,而身体区的铁含量则有所增加(图3 B-D),血液中检测到大量富含铁的红细胞(图3 E-F)。因此alas2和alad突变体的铁稳态被破坏。
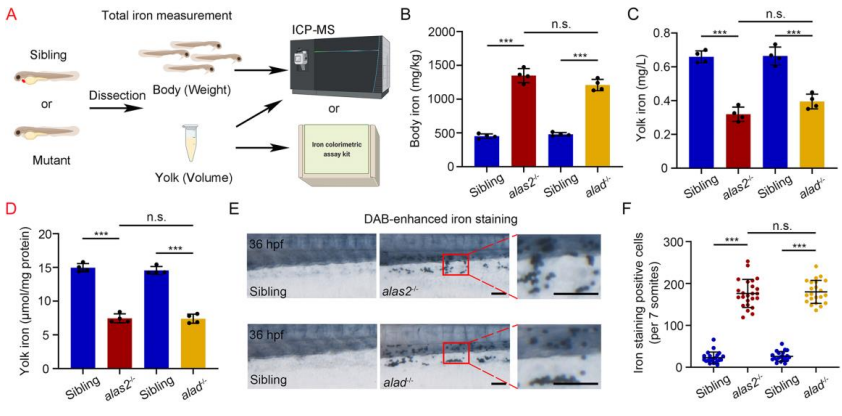
图3. 缺乏血红素的RBCs出现铁积累
3. 缺乏血红素的RBCs通过SLC40A1诱导血液IOL
为了评估血铁水平,检测心脏区域(对照组)、alas2和alad突变体的血液的血铁含量(图4 A)。两种突变体的血铁显著升高(图4 B-C),表现出相似的血液铁过载(iron-overload, IOL)表型。对缺乏血红素的RBCs进行RNA-Seq测序,旨在揭示突变体引起血液IOL的潜在机制(图4 D)。富集分析发现差异基因主要富集在“铁转运”“离子稳态”“红细胞分化”通路(图4 E-F)。热图分析显示slc40al(铁蛋白)在两种突变体中表达显著上调(图4 G),且Slc40a1 mRNA水平在血红素缺乏型RBCs也是上调(图4 H-J)。抑制剂与Slc40a1结合阻断铁流出,导致突变体的血液和红细胞中的铁含量分别显著降低和升高,而卵黄区的铁含量无变化,表明缺乏血红素的RBCs会诱导血液铁超载。经抑制剂处理后,突变体的HSPCs缺陷恢复(图4 K-L)。因此缺乏血红素的RBCs通过铁蛋白Slc40a1诱导血液 IOL,从而以非细胞自主的方式导致 HSPC 缺陷。
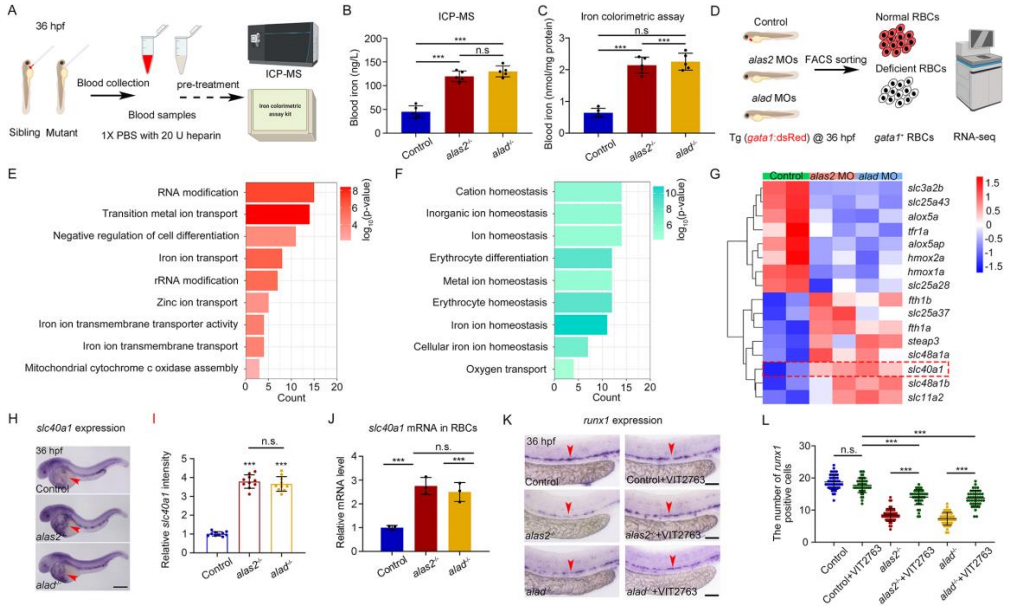
图4. 缺乏血红素的RBCs通过 SLC40a1 造成血液IOL
4. Tfr1b 在血液IOL条件下介导HSPC铁死亡
突变体中HSPCs的线粒体萎缩,嵴包裹,细胞质和细胞器肿胀,质膜破裂,以及质膜中双膜小泡的形成(图5 B-F)。脂氧合酶(alox5、alox12和acsl4a)在alas2或alad突变体的HSPCs中显著上调,而在RBCs中正常表达,且脱铁抑制剂的蛋白水平都显著降低(图5 G-I),表明铁死亡过程在突变体的HSPCs被激活。
抗脱铁试剂去除alas2或alad突变体中的过量铁后,铁过量的RBCs数量显著减少,同时HSPCs缺陷也得到有效修复(图5 Q-X)。转铁蛋白受体家族(tfr1b)在AGM区域特异性富集,在kdrl+/cmyb+ HSPCs中的特异性表达。AGM区域中,tfr1b的mRNA水平和蛋白水平在突变体的HSPCs上调,敲除tfr1b能有效逆转突变体HSPCs 的Fe2+过载表型并恢复HSPCs缺陷。因此,tfr1b的上调可能介导了血液IOL条件下HSPCs对铁的过度吸收。
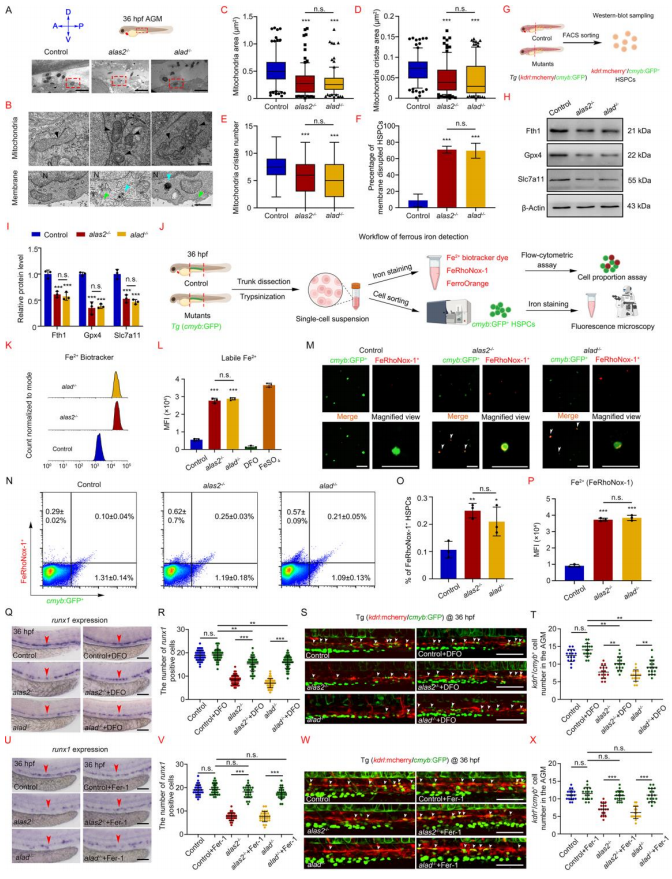
图5. alas2和alad突变体中的铁依赖性HSPC铁突变
5. alas2或alad突变体AGM区域的ROS水平升高
为了测试HSPCs脱铁性贫血是否由铁相关的氧化应激诱导,评估alas2和alad突变体AGM区域的ROS水平和氧化状态(图6 A)。两种突变体胚胎的ROS水平升高,而缺失血红素的RBCs胚胎的ROS 水平无变化。突变体的背主动脉(dorsal aorta,VDA)中kdrl+/MitoSOX+细胞的数量显著增加(图6 B-C),alas2和alad突变体的HSPCs的ROS水平均明显升高且受到更强的氧化应激(图6 D)。铁螯合有效抑制ROS的产生,ROS清除剂显著降低突变体的AGM中的ROS水平,HSPCs缺陷也得到了有效恢复(图6 E-J)。因此,alas2和alad突变体的HSPCs突变导致AGM 区域铁依赖性ROS的升高。
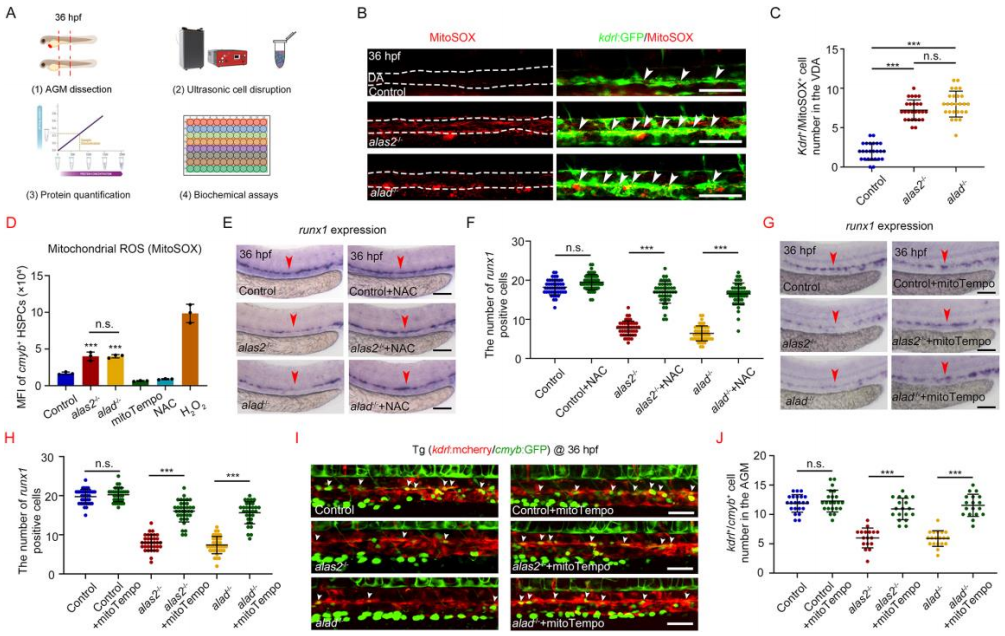
图6. alas2和alad突变体中HSPCs的ROS水平升高
6. 铁诱导的ROS导致alas2和alad缺陷胚胎AGM区域的脂质过氧化
非靶向代谢组学检测和靶向氧化脂质组学检测alas2和alad 突变体胚胎中代谢物的变化。上调的差异代谢物主要富集于不饱和脂肪酸生物合成途径,而下调的差异代谢物富集于花生四烯酸(AA)代谢途径。热图显示AA及其下游代谢产物明显减少,包括前列腺素G2、前列腺素D2、9-HETE、12-HETE、8-HEPE等。部分氧化脂质来源于alas2和alad 突变体中的AA过氧化(图7 B)。其中,与5S相关的(5S-HEPE、5S-HETE和5S-oxoETE)和12S相关的氧化脂质(12S-HEPE、12SHHTrE和12S-HETE)分别在alas2和alad 突变体中高度富集,这与AA相关代谢物的减少一致(图7 C)。
为了研究差异代谢物的原位变化,对alas2和alad 突变体的AGM区域进行了横截面成像(图7 D)。在alas2和alad 突变体的AGM区域,AA和1-花生四烯酸糖磷酸肌醇显著降低,而脂质过氧化前体琥珀酰辅酶A增加(图7 E-F),表明参与AA代谢途径的脂质在alas2和alad 缺陷胚胎的AGM区域发生了改变。Acsl4抑制剂处理导致alas2和alad 突变体主干区的丙二醛(Malondialdehyde,MDA)含量降低(图7 G),HSPC缺陷部分得到修复(图7 H-I)。
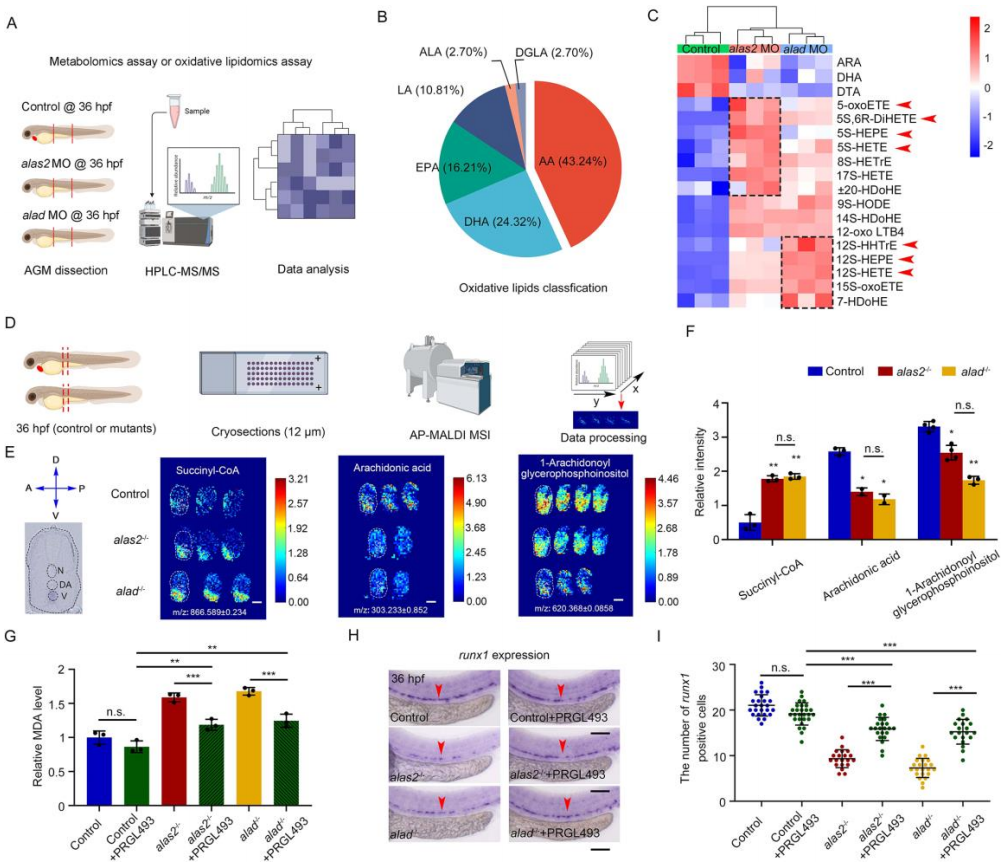
图 7. 铁介导的AA氧化会导致5S和12S相关铁变态刺激物的过度产生
7. 在alas2和alad缺陷胚胎中,红细胞型HSPC的形成受损
为了确定受损HSPC亚群的功能作用,检测alas2和alad突变体中HSPCs的多谱系分化。结果表明,髓系细胞(pu.1, l-plastin 和 lyz)和淋巴系(rag1)标记物均正常表达,而HSPC(cmyb)和红系(gata1)标记物的表达明显降低。
为了进一步验证上述发现,使用流式细胞术进行HSPCs移植实验(图8 A)。移植后45天(dpt),alas2和alad突变体HSPCs衍生的ubi:dsRed+细胞的比例显著低于对照组图(图8 B-C)。多谱系分析表明,alas2和alad突变体衍生的HSPCs的红系谱系重建效率明显降低(图8 D-E),接受alas2和alad形态HSPCs移植的受试者外周血的循环RBCs的数量减少(图8 F)。二次移植结果显示在45 dpt时,对照和变体衍生的HSPCs都表现出相似的重建效率和同等的多谱系再繁殖潜力(图8 G-H),在缺乏血红素的原始红细胞诱导的铁超载应激条件下,有红细胞偏倚的HSPC会发生铁突变。因此,在alas2和alad缺陷的胚胎中,铁突变性HSPCs很可能偏向红细胞,而多系再充填HSCs的生成则不受影响。
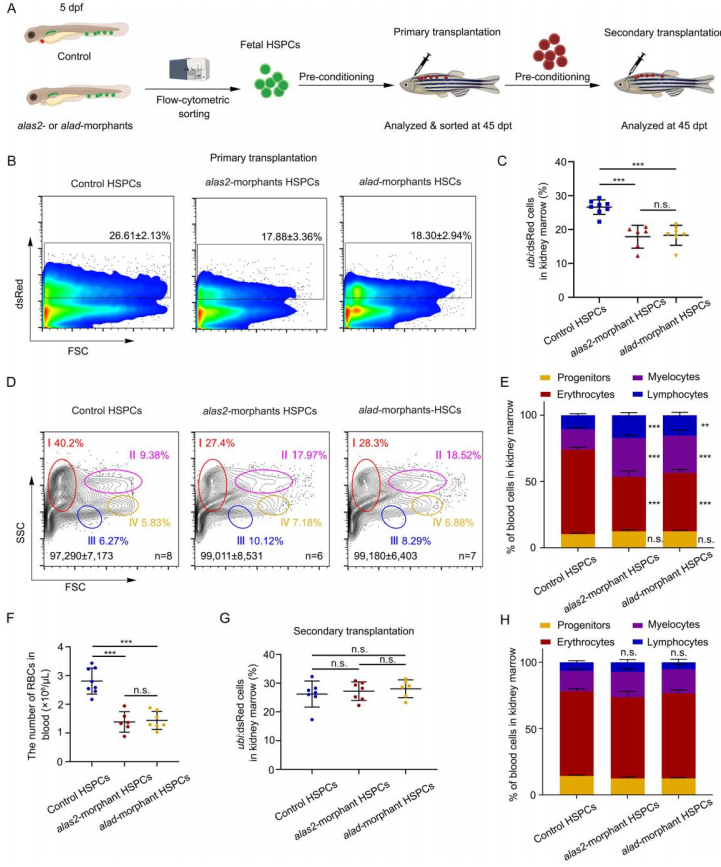
图 8. 来源于alas2和alad缺陷胚胎的HSPCs显示出较低的红系重组效率
本文揭示了血红素缺乏的原始红细胞可通过损害AGM区域的铁平衡诱导最终的HSPCs铁死亡。因此,局部血铁水平较高不利于HSPCs的生成。铁诱导的过量ROS生成是脂质过氧化的主要原因,从而引发了HSPCs铁死亡。因此,血红素缺乏的原始红细胞-铁-ROS-脂质过氧化轴在血液IOL应激条件下的HSPCs铁死亡中起着至关重要的作用。










