

期刊:nature cardiovascular research
影响因子:9.4
合作单位:中国人民解放军陆军特色医学中心
百趣提供服务:靶标代谢组
心肌梗死(Myocardial Infarction, MI)是全球主要的死亡原因之一。新生哺乳动物心脏损伤后可通过心肌细胞增殖再生,但在出生后7天失去这种潜力。在成年哺乳动物中,心肌梗死后心肌细胞(Cardiomyocytes, CMs)的大量丢失常常导致心力衰竭。尽管在梗死边缘的一小部分已有的心肌细胞会重新进入细胞周期,但这并不足以补充成年哺乳动物中丢失的心肌细胞。因此,如何增强成年心肌细胞的增殖能力是心脏修复和再生的主要目标。刺激成人心肌细胞重新进入细胞周期尚不清楚。本文作者通过系列研究发现心肌细胞的增殖取决于其代谢状态并发现α-酮戊二酸(α-ketoglutarate, α-KG)通过JMJD3依赖性去甲基化促进心肌细胞增殖,为治疗心肌梗死提供了一种潜在的方法。作者将研究结果发表在心血管权威杂志nature cardiovascular research上。
1. α-KG促进CM增殖和心脏再生
代谢和增殖之间有着紧密的联系,因此,研究人员通过代谢组学研究,比较了新生小鼠心脏在不同发育阶段的TCA循环代谢物的变化情况。研究发现,α-酮戊二酸(α-KG)在P0.5(再生期)和P7(非再生期)小鼠心脏中的水平有显著差异,且在下调代谢物中排名第一。通过ELISA验证了α-KG的表达变化,并在P7小鼠中注射α-KG以探究其生理作用。结果表明,α-KG处理能够增加心重与体重之比(HW/BW),提高心肌细胞中Ki67+、PH3+和Aurkb+的表达,促进CM的增殖(图1a-c)。此外,α-KG处理还增加了CM的总数,这与单核心肌细胞的增加和双核心肌细胞的减少有关(图1e)。这些发现揭示了α-KG在心脏再生和心肌细胞增殖中的潜在重要性。
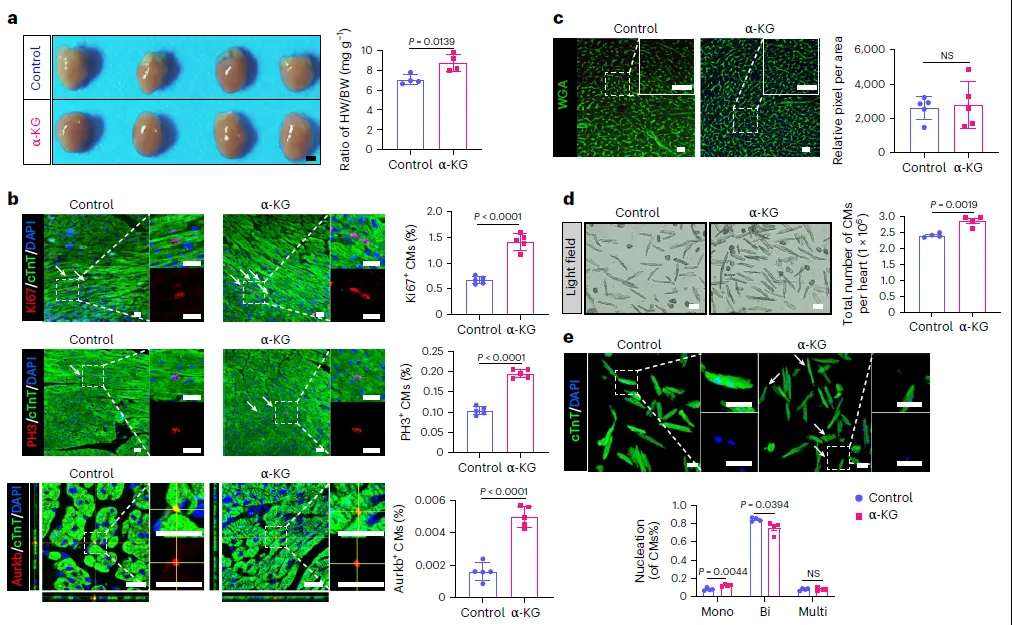
图1. α-KG诱导CM在发育过程中增殖
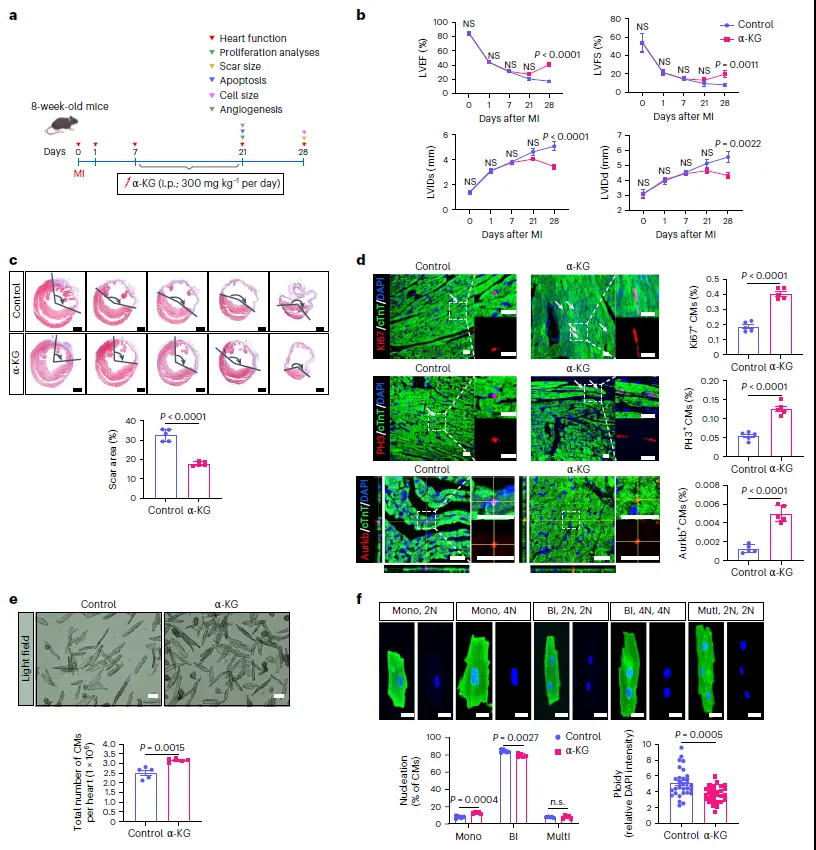
继研究α-KG对发育中的心脏所起的作用外,作者随后探讨了α-酮戊二酸(α-KG)对成年心肌梗死小鼠心脏的影响。通过结扎小鼠的左前降支(LAD)来模拟心肌梗死,对小鼠进行了为期两周的α-KG腹腔注射(每天300 mg/kg)。结果显示,α-KG注射显著提升了心脏功能,包括增加左室射血分数(LVEF)和左室缩短分数(LVFS),减少左室扩张(图2a)。此外,心肌梗死后4周的梗死面积减小(图2b),心肌细胞增殖标志物Ki67+、PH3+和Aurkb+的表达增加(图2c),血管生成增加(图2d),以及心肌细胞凋亡减少。此外,α-KG处理还增加了心肌细胞的数量,降低了单核心肌细胞的倍性,并减轻了心肌肥厚(图2e)。通过谱系追踪技术,研究证实了α-KG促进了心肌细胞的分裂和形成(图2f)。组织学染色显示,α-KG处理未引起明显的组织形态学和病理学变化(图2g)。这些发现表明α-KG对心肌梗死后心脏的修复和再生具有潜在的促进作用。

图2. α-KG促进心肌梗死后CM的增殖
为了更具体地确定α-KG在刺激CM增殖中的作用,而不是在心肌梗死后早期阶段的保护作用,作者在心肌梗死后7天开始,每天腹腔注射α-KG,持续2周(图3a)。结果显示,α-KG能改善心脏功能,减少疤痕,增加CMs增殖,并降低多倍体细胞数量(图3b-f)。
这些数据表明,外源性补充α-KG通过诱导心肌细胞增殖来改善心肌梗死后的心功能。
2. α-KG通过降低H3K27me3和H3K4me3激活细胞周期
通过体外实验证实α-KG对CMs的增殖作用。α-KG诱导离体P1和成年小鼠的CMs增殖,通过Ki67染色和延时显微镜成像(图4a-b),以浓度(0.1-10 mM)依赖的方式进行。

图4. α-KG促进CM体外增殖
为了探索α-KG促进心脏肌肉细胞(CMs)增殖的潜在途径,科研人员对注射α-KG和对照组(PBS)的小鼠CMs进行了RNA测序。结果显示,α-KG处理后有2095个基因表达差异,其中397个下调,1698个上调(图5a)。基因功能分析表明,上调基因主要与细胞增殖相关,如细胞周期和有丝分裂(图5b)。细胞周期基因表达在α-KG处理后增加(图5c-d),体外实验也证实了这一点。此外,α-KG还降低了与CM成熟相关的基因表达(图5e-f),如Tnni3、Mylk2、Myh6和Cacna1g,这与α-KG抑制CM成熟的报道一致。
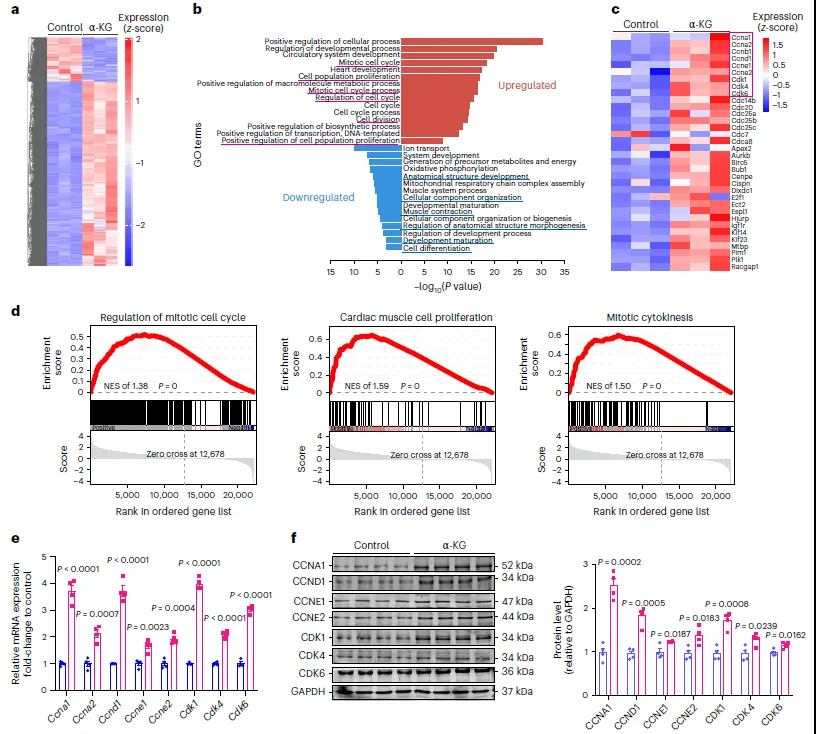
图5. α-KG刺激细胞周期基因转录
先前有研究表明α-KG通过驱动肝脏产生KYNA对缺血再灌注损伤具有保护作用,作者进一步研究KYNA是否在α-KG诱导的CM增殖中起作用。研究表明,α-KG能促进心脏肌肉细胞(CMs)的增殖,但这一作用并不依赖于KYNA的产生。先前的研究表明α-KG通过影响组蛋白甲基化,特别是H3K27me3和H3K4me3,来调控染色质可及性和基因表达。本次通过筛选比较,在心脏发育过程中,H3K27me3水平随时间升高,而α-KG能够减少CMs中H3K27me3的增加(图6a-c)。通过ChIP-seq分析,发现α-KG降低了细胞周期基因启动子上H3K27me3的富集(图6d-f),而对成熟基因启动子上的H3K27me3和H3K4me3没有显著影响(图6g-h)。这表明α-KG可能通过减少细胞周期基因上的抑制性组蛋白标记H3K27me3,以及成熟基因上的激活性标记H3K4me3,来促进CMs的增殖。
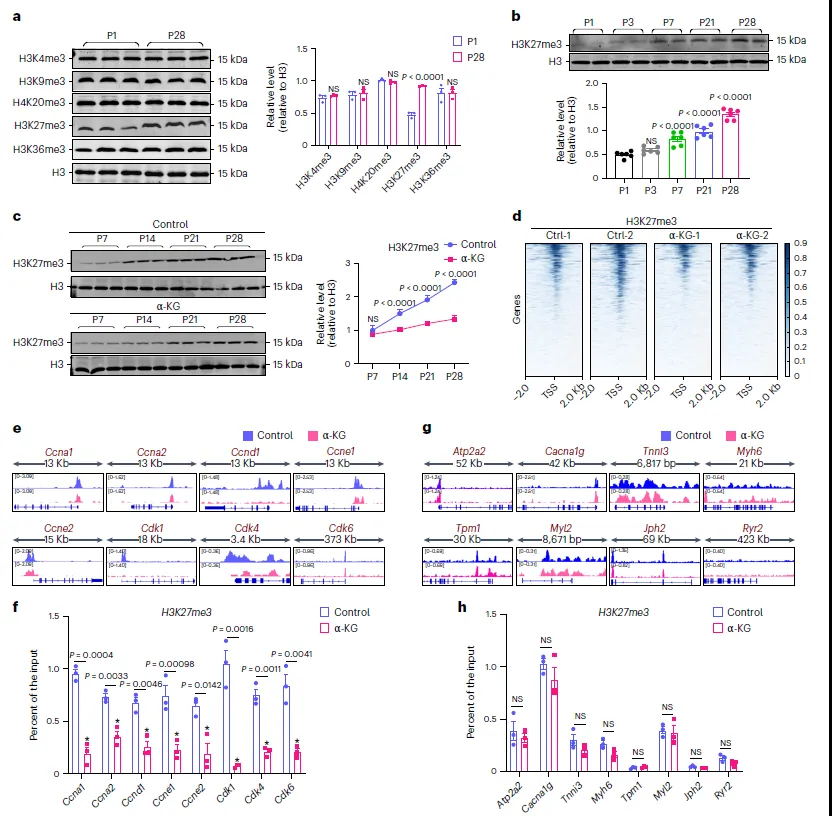
图6. α-KG减少H3K27me3在细胞周期基因上的沉积
α-KG是KDM6酶家族成员的辅酶因子,KDM6酶包括KDM6A(UTX),KDM6B (JMJD3)和KDM6C(UTY)。但KDM6C因其结构域催化活性位点的突变而不能实现H3K27me3去甲基化。因此,作者进一步研究了JMJD3和UTX在α-KG诱导的CM增殖和H3K27me3去甲基化中的作用。研究表明,通过siRNA沉默JMJD3能阻断α-KG促进的心脏肌肉细胞(CMs)增殖和H3K27me3去甲基化(图7a-b),表明α-KG可能通过JMJD3调节心脏H3K27me3甲基化。α-KG能增加JMJD3活性和表达,JMJD3抑制剂GSK-J4能阻断α-KG的CM增殖作用,而过表达JMJD3则增强α-KG诱导的CM增殖(图7c-f)。此外,α-KG处理或Ogdh(α-KG脱氢酶)敲低能增加CMs中α-KG水平,影响氨基酸代谢和TCA循环,提高氨基酸水平,但其对CM增殖的具体影响还需进一步研究。

图7. JMJD3介导α-KG诱导的CM增殖
3. Ogdh(α-KG脱氢酶)敲低促进心肌梗死后CM增殖
为了揭示导致成年小鼠内源性α-KG水平低于年轻小鼠的机制,作者利用已发表的P1、P4、P9和P23小鼠心脏的转录组测序和蛋白质组学数据筛选了α-KG产生相关途径。结果发现成年小鼠心脏中Ogdh的表达和活性随年龄增长而增加,这可能是成年小鼠α-KG水平低于年轻小鼠的原因。通过siRNA降低Ogdh表达可以增加α-KG含量,并促进心肌细胞的增殖(图8a)。使用腺相关病毒(AAV9)敲低Ogdh可以减少心肌梗死后的细胞凋亡,改善心功能,减少瘢痕,并增加CMs的增殖(图8b-d)。另外,还评估了心肌梗死后AAV9-Ogdh-shRNA和AAV9-EGFP对总CM数、成核和倍性水平的影响,与α-KG处理心脏的结果一致(图8e-f)。这些发现表明,Ogdh的下调可能通过增加α-KG积累来促进心肌梗死后CMs的增殖和心脏再生。

图8. 内源性α-KG促进CM增殖
细胞代谢,尤其是TCA循环中的α-KG,对心肌细胞的增殖具有重要调节作用。研究发现,α-KG水平在心脏发育早期降低,而外源性α-KG能够促进心脏再生和CMs的增殖。α-KG通过JMJD3依赖性的去甲基化作用降低H3K27me3和H3K4me3水平,从而促进CMs增殖。此外,α-KG还能通过提高CMs中的氨基酸水平,可能参与调节CM增殖。OGDH的上调可能是成年小鼠α-KG水平低于年轻小鼠的原因,而OGDH的下调可以通过增加内源性α-KG水平来促进CMs的增殖。这些发现表明,α-KG及其代谢途径可能成为治疗心肌梗死和心力衰竭的潜在方法。









