

期刊:Advanced Science
影响因子:14.3
合作单位: 上海交通大学医学院附属第九人民医院
百趣提供服务:转录组学+中心碳高通量靶标代谢组学
如何修复由创伤和疾病引起的大型承重骨缺损一直是临床上的难题。在组织工程领域,应用生物支架等骨替代材料代表了一种有前景的承重骨修复方法。与金属或陶瓷材料相比,聚醚酮酮(Polyetherketoneketone, PEKK)由于其优越的机械性能而被认为是潜在更理想的骨替代材料。然而,它的固有生物惰性会影响植入体的长期稳定性,引起强烈的炎症反应和成骨细胞功能障碍。因此,需要设计更有针对性的方法来克服这些限制。文章通过仿生学的方法制备出具有一种类似肝脏ECM结构的PEKK支架,发现它能够模拟肝脏组织的信号传导机制,从而促进骨骼再生和减轻炎症反应。这一研究不仅提供了一种新的骨缺损修复方法,也为开发更有效的生物医学材料提供了思路。
1. 肝脏细胞外骨架结构触发MET信号
在天然组织中,肝组织表现出突出的再生能力,许多生长因子,尤其是肝细胞生长因子(Hepatocyte growth factor, HGF),在组织再生中起着重要作用。MET是肝细胞生长因子受体(hepatocyte growth factor receptor),是伤口修复和器官稳态的基础。有研究指出,肝细胞ECM结构与MET信号之间存在着潜在的协同关系,MET信号与巨噬细胞M2极化存在显著强相关。作者进一步通过肝脏细胞ECM结构探索形态学线索与组织再生过程中生物信息的关系。结果发现脱细胞后的肝细胞ECM结构,能够明显促进MET信号的表达(图1)。
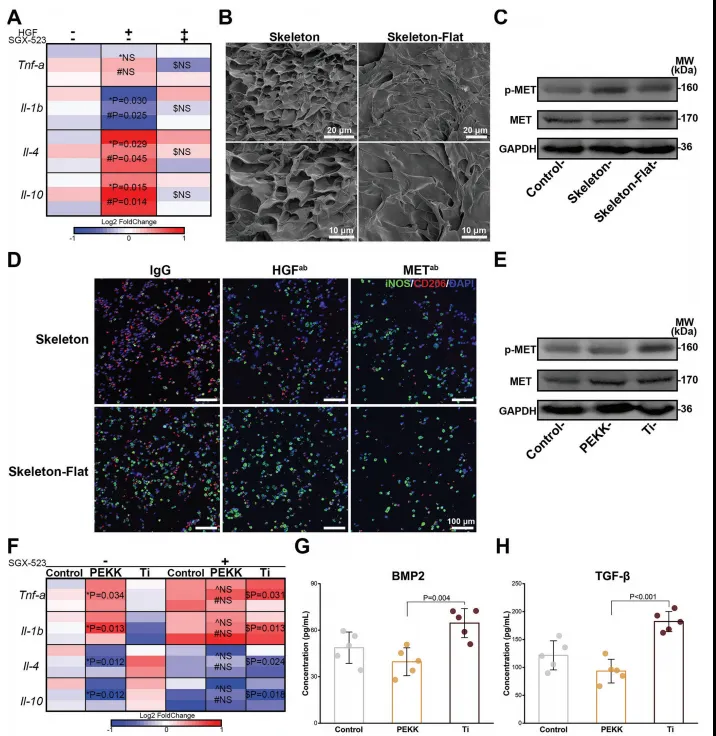
图1. 肝脏细胞外骨架触发MET信号
2. 仿生PEKK支架的制备与表征
受此线索启发,作者通过物理和化学手段构建了肝脏细胞ECM结构,通过仿生学的方法制备出具有类似肝脏ECM结构的PEKK支架(PEKK-L),并对其进行了表征和分析(图2)。发现PEKK-L的表面形态与肝脏ECM结构相似,而机械性能与天然骨组织高度相似。
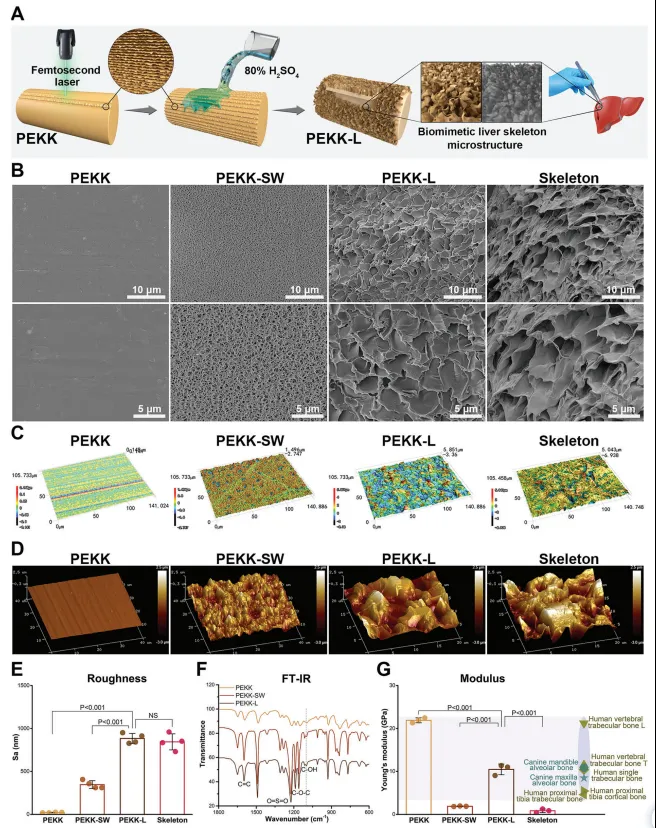
图2. 仿生PEKK支架的制备与表征
3. PEKK-L支架的生物相容性和模拟MET信号传导
通过细胞实验和动物实验对PEKK-L支架的生物相容性及MET信号传导途径展开研究。结果发现,PEKK-L具有良好的细胞活力和细胞黏附性(图3)。此外,Ras通路作为MET的经典下游信号通路,在PEKK-L支架作用下被显著激活。同时,RNA测序(百趣生物提供)显示了在不同支架上巨噬细胞的Ras信号通路相关的差异表达基因(Differentially expressed genes, DEGs)。PEKK-L组中Met及其下游基因T-淋巴瘤侵袭转移诱导蛋白1(T-lymphoma invasion and metastasis-inducing protein 1, Tiam1)显著上调。在蛋白水平验证了MET-TIAM1轴的信号传导(图3G)。
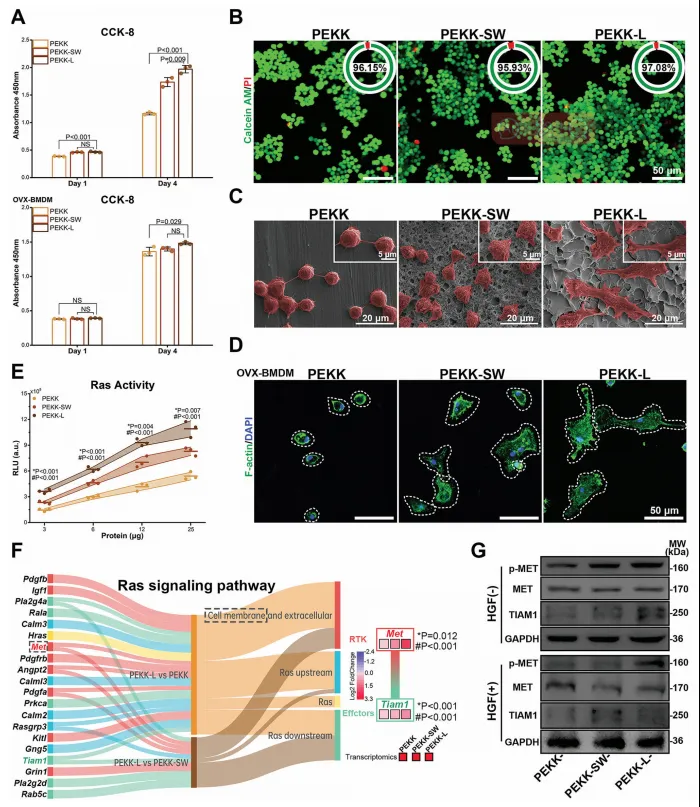
图3. 仿生PEKK支架的生物相容性及功能仿生学研究
4. 能量代谢是由仿生结构调控的重要生物过程
为了进一步揭示仿生表面涉及引起巨噬细胞反应中的潜在机制及其相关性,对转录组得到的DEGs做进一步的功能富集分析。通过KEGG数据库对7条显著富集的信号通路进行分析,其主要属于能量代谢碳源途径。GO数据库的富集分析显示,这些基因在能量代谢中高度富集,包括能量产生、氧化磷酸化(OXPHOS)和线粒体复合物。因此,选择中心碳高通量靶标代谢组学(百趣生物提供)进一步研究能量代谢。结果显示,富马酸盐和琥珀酸盐两种代谢物明显增加。综合RNA测序和中心碳代谢结果表明,相关基因和代谢物主要富集于OXPHOS、TCA循环、戊糖磷酸途径、糖酵解、钙信号通路、精氨酸生物合成和酪氨酸代谢。富马酸盐代谢受琥珀酸脱氢酶调控,与精氨酸代谢有关(图4)。与此一致的是,精氨酸代谢和酪氨酸代谢分别参与巨噬细胞极化和Ras信号通路。因此,能量代谢可能是由仿生形态激活的Ras信号与最终极化表型之间的桥梁。
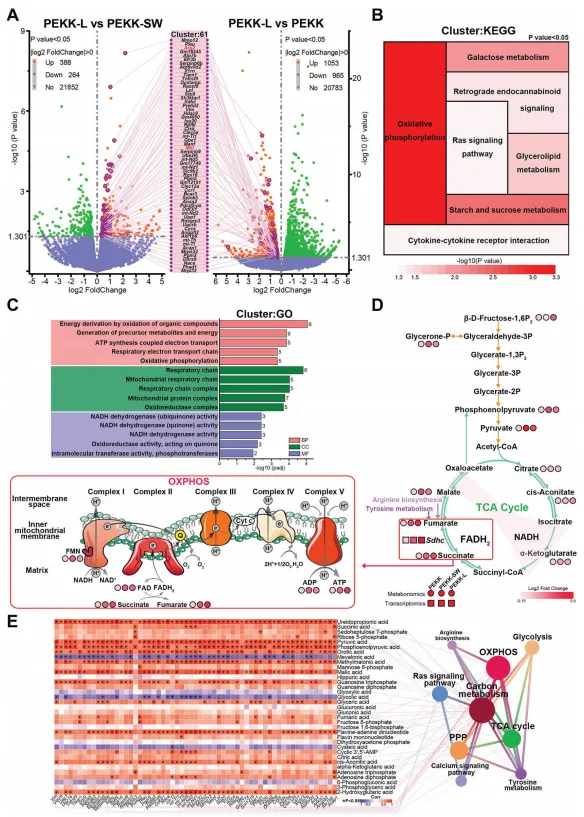
图4. 潜在机制的探索及功能富集分析
5. PEKK-L通过复合物II促进巨噬细胞线粒体呼吸
鉴于能量代谢中的显著差异,文章对线粒体呼吸和动力学进行了进一步研究。耗氧量分析显示,PEKK-L组的基础呼吸、ATP产生和最大呼吸增加。此外,观察到更高的ATP/ADP比值。线粒体形态和功能随着细胞表型的不同而变化。Mfn2和Drp1基因的表达与这些发现一致。仿生设计最大限度地提高了恢复线粒体膜电位和提高OXPHOS水平的能力。对电子传递链的进一步研究表明,与生物分析相一致,主导线粒体呼吸过程的是复合体II,下游富马酸盐的增加也与上述结果相呼应。这些结果表明,PEKK-L能够增强线粒体呼吸。
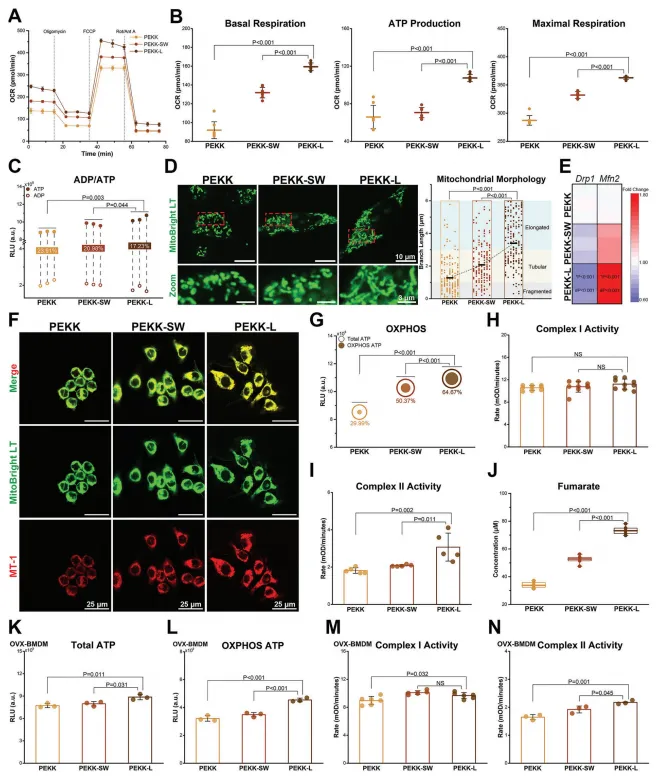
图5. 支架调节巨噬细胞的线粒体呼吸和线粒体动力学
6. PEKK-L诱导MET信号激活的Arg2易位重编程精氨酸代谢和能量代谢
实验研究发现,仿生PEKK支架促进精氨酸的水解。因此,进一步检测了精氨酸水解的两种关键酶(Arg1和Arg2)的表达,发现其水解由Arg2主导。此外,结合精氨酸酶表达分析发现,精氨酸酶活性的差异发生在细胞质内而不是线粒体内,这与常规认为的Arg2定位于线粒体,Arg1定位于细胞质的现象不符。因此,推测PEKK-L表面巨噬细胞中的Arg2发生了逆行易位,免疫电镜结果也证实了上述推测。通过分子对接模拟及共免疫沉淀发现Arg2的转移可能通过线粒体的胞质伴侣蛋白之间的协同作用而发生。总的来说,如图6T所示,仿生学设计激活了MET/Ras/TIAM1信号传导,并在cHSP70和HSP40的帮助下介导了Arg2的逆行转运,导致精胺和线粒体呼吸增加。Arg2的逆行转运连接了能量代谢和由仿生形态激活的MET/Ras/TIAM1信号传导,并诱导了最终的极化表型。
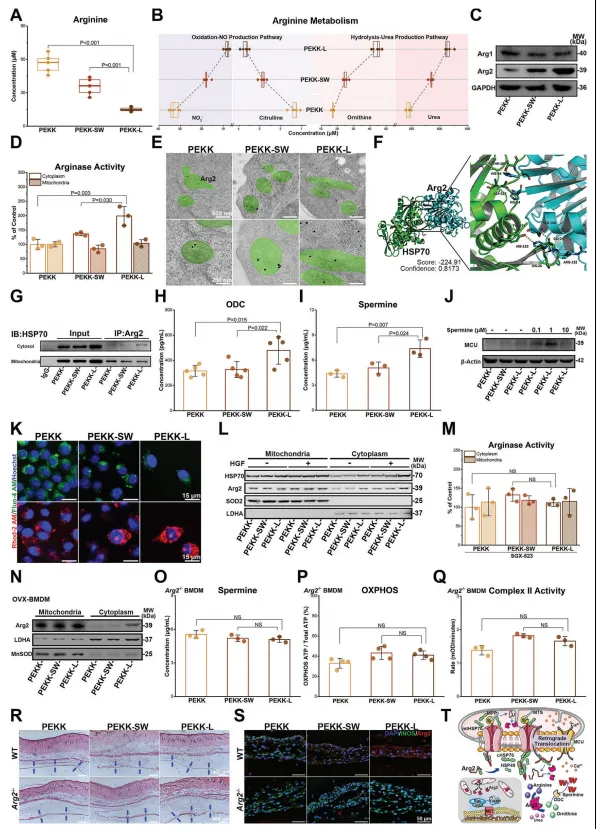
图6. PEKK-L诱导Arg2易位重编程精氨酸代谢和能量代谢
7. PEKK-L促进M2极化并增强免疫敏感性,通过调节微环境可促进骨再生
通过对RAW264.7细胞的实验观察,发现PEKK-L表面修饰能够促进巨噬细胞向M2极化方向转化,并且增强抗炎基因表达和释放抗炎因子的能力(图7)。同时,通过添加不同浓度的刺激(LPS或IL-4)使细胞极化,检测下游分子来评估反应效率,进一步验证了PEKK-L表面修饰对于巨噬细胞极化和免疫调节的积极影响。这些结果表明,PEKK-L表面修饰可以有效地协调巨噬细胞极化调节和免疫调节,从而加速组织修复过程。之后通过模拟肝脏骨骼结构来调节微环境,发现PEKK-L组条件培养基中含有更多有利于成骨的细胞因子,促进了成骨细胞分化。动物实验结果表明,PEKK-L可以增强新骨形成并改善骨折愈合(图8)。
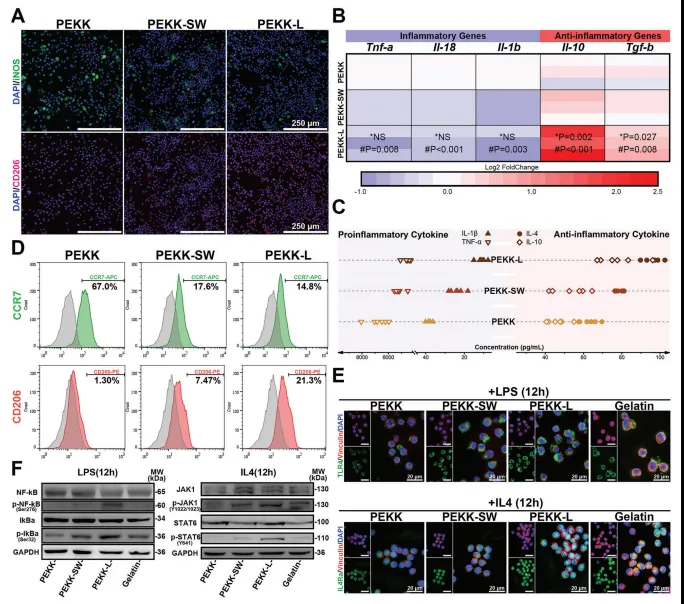
图7. PEKK-L体外调控巨噬细胞极化和免疫敏感性
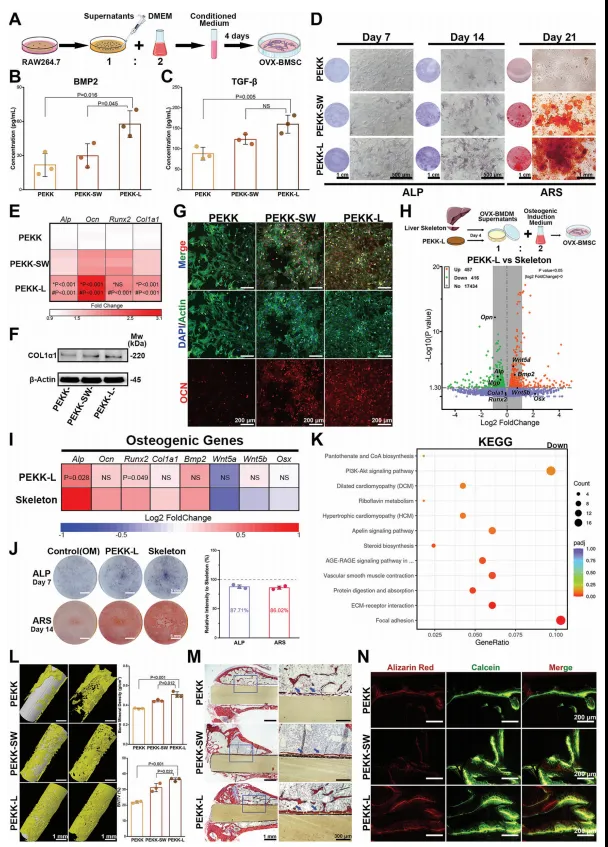
图8. 调节微环境促进骨再生
文章通过仿生学原理从肝脏的结构特征中获得灵感,并利用这种设计制造出具有生物调节能力的PEKK仿生支架。该特征结构能够明显促进MET信号的表达,并通过MET信号传递给巨噬细胞,并导致来自线粒体的Arg2向胞质逆向转移。这一转移导致精胺和线粒体呼吸增加,驱动巨噬细胞的能量代谢和精氨酸代谢的重编程。该策略模拟了形态学线索和相应的生物功能信号,实现了功能仿生学,对于开发新型生物材料和治疗骨质疏松等方面具有重要的意义。
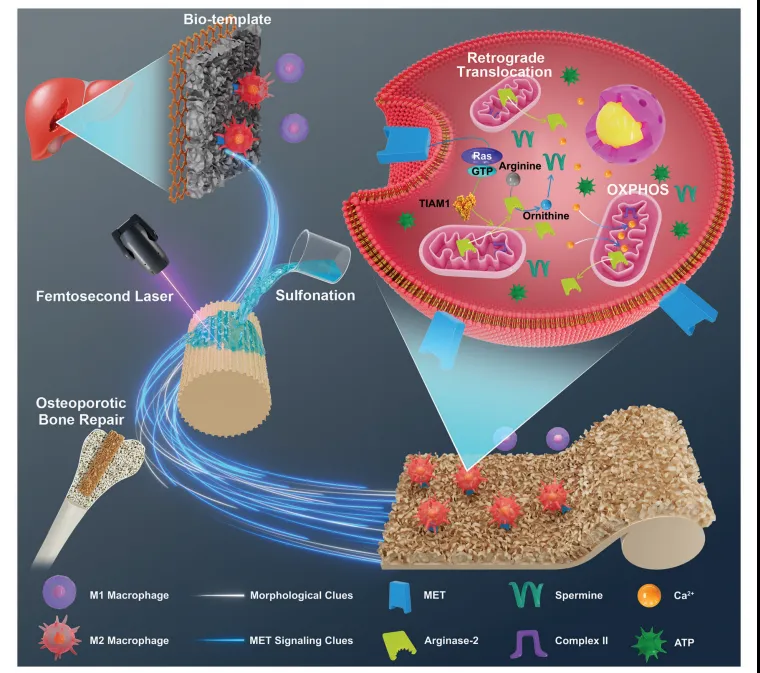
图9. 图示以肝脏细胞外骨架结构为生物模板的PEKK仿生支架设计及通过引导正向免疫调节以促进骨再生中的巨噬细胞代谢重编程的机制









