发表期刊:Science Advances
影响因子:14.95
作者单位:浙江大学医学院附属邵逸夫医院
百趣提供服务:iTRAQ/TMT标记定量蛋白质组
研究背景
骨关节炎(Osteoarthritis,OA)是一种退行性疾病,伴有一系列代谢变化和酶的改变。本研究报道了二甲基精氨酸二甲氨基水解酶-1(dimethylarginine dimethylaminohydrolase-1, DDAH1)的下调伴随着变性软骨细胞和OA样本中不对称二甲基精氨酸(asymmetric dimethylarginine, ADMA)的增加。整体或条件性敲除软骨细胞的ADMA水解酶DDAH1加速了小鼠OA的发展。ADMA诱导软骨细胞变性和衰老,减少细胞外基质沉积,从而加速OA的进展。ADMA同时与SOX9及其去泛素化酶USP7结合,阻断USP7对SOX9的去泛素化作用,从而导致SOX9降解。OA患者滑液中ADMA水平升高,对OA诊断具有良好的敏感性和特异性的预测价值。因此,激活DDAH1以降低ADMA水平可能是OA治疗的潜在治疗策略。
技术路线
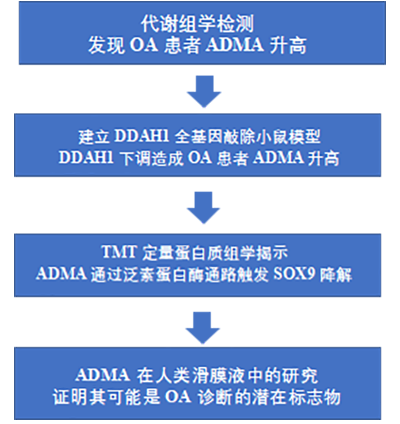
研究结果
01 骨性关节炎软骨细胞中ADMA升高会引发软骨变性
针对6名OA患者和6名相对健康的患者(膝关节骨折,无OA病史)开展代谢组学分析,两组出现一系列的代谢物差异。在上调TOP25的代谢物中,ADMA具有最高的统计学显著性,其异构体对称二甲基精氨酸(Symmetric dimethylarginine, SDMA)没有实质性变化(图1 B)。为了研究ADMA是否能在体内诱导OA,作者在内侧半月板失稳(destabilization of the medial Meniscus, DMM)手术1周后将ADMA直接注射到小鼠膝关节。ADMA在DMM手术中显著加速软骨退变,促进骨赘形成。此外,免疫组织化学染色证实,暴露于ADMA的软骨中II型胶原和聚集蛋白的表达降低。热板分析、旋转杆实验和野外实验显示,注射ADMA的小鼠疼痛阈值和移动能力明显降低。总之,这些数据表明,退化软骨细胞中ADMA的增加会引发软骨变性和衰老。
02DDAH1下调导致OA患者ADMA升高
ADMA是在精氨酸与甲基化残基的蛋白分解过程中释放出来的,随后被DDAH家族或AGXT2水解。作者使用DDAH1抑制剂PD 404182来探究DDAH1在OA中的作用。结果显示ADMA在PD 404182处理的软骨细胞中急剧升高(图1 C)。此外,ADMA在DDAH1−/−(DDAH1全基因敲除小鼠)原代软骨细胞中升高(图1 D)。这些数据表明,DDAH1在OA进展中受到抑制,从而增加了软骨细胞中的ADMA水平。此外,Western blotting和免疫组织化学验证了DDAH1的缺失(图1 H)。微团培养和3D琼脂糖培养显示,DDAH1−/−原代软骨细胞中ECM沉积较低(图1 E、F)。虽然在20周龄的DDAH1 - / -小鼠中没有观察到明显的OA相关表型,但DDAH1缺失明显加速了DMM诱导的OA小鼠的软骨退变(图1 G)。免疫组织化学显示,DDAH1 - / -小鼠软骨中的II型胶原和聚集蛋白减少(图1 H),可以确定ADMA在DDAH1的作用下可以快速水解。
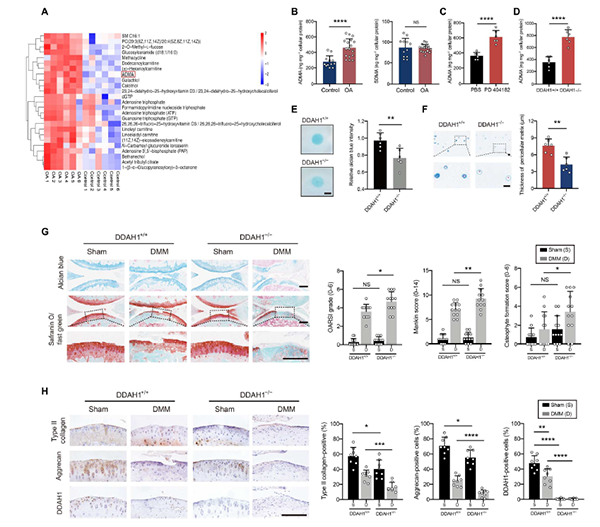
图1. DDAH1上调ADMA加速OA进程
03软骨特异性DDAH1参与骨关节炎进展
为了进一步研究DDAH1的作用,作者建立DDAH1fl/fl(DDAH1条件敲除小鼠)小鼠模型,发现在软骨细胞中ADMA表现出高表达状态。RT-PCR结果显示合成代谢因子(COL2A1和ACAN)降低,分解代谢因子(MMP3和MMP13)升高(图2 A);此外,DDAH1缺失后,aggrecan和COL2A1的蛋白表达显著下调(图2 B)。为了排除DDAH1对骨骼的影响,作者使用Col2-CreERT2和ACAN-CreERT2小鼠产生DDAH1条件敲除小鼠,使软骨细胞中DDAH1基因条件缺失。与对照组相比,软骨中DDAH1的缺失会导致DMM手术后更严重的软骨损伤(图2 C)。此外,DDAH1fl/fl、Col2-CreERT2和DDAH1fl/fl、ACAN-CreERT2小鼠软骨中II型胶原蛋白和聚集蛋白的表达明显降低(图2 D)。同时,在DDAH1fl/fl, Col2-CreERT2和DDAH1fl/fl, ACAN-CreERT2小鼠中观察到更多的骨赘(图2 E)。作者也对软骨下骨密度进行了研究,发现DDAH1fl/fl, Col2-CreERT2和DDAH1fl/fl, ACANCreERT2小鼠均表现出更高的软骨下骨体积(图2 F)。热板、旋转杆和野外实验表明,DDAH1fl/fl、Col2-CreERT2和DDAH1fl/fl、ACAN-CreERT2小鼠对疼痛更敏感,并有一定程度的运动障碍(图2 G)。LC-MS证实了DDAH1过表达的软骨细胞中ADMA水平降低。说明DDAH1可部分逆转DMM诱导的小鼠骨性关节炎。
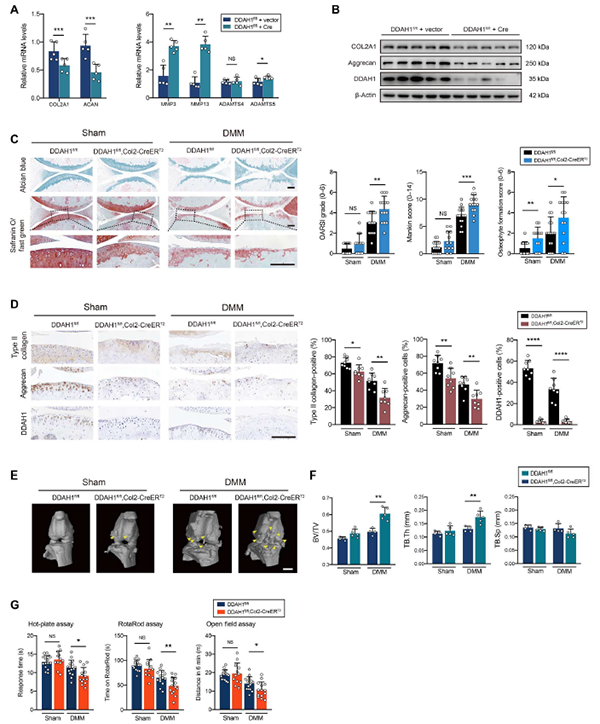
图2. 特异性敲除DDAH1加速OA发展
04ADMA激活SOX9的泛素-蛋白体途径
ADMA作为一种内源性一氧化氮合酶抑制物,可以通过NO影响病理生理过程,通过实验证明ADMA诱导软骨细胞退变不依赖于NOS/NO途径。为了更好地了解ADMA诱导软骨细胞变性机制,作者对ADMA处理的细胞进行了TMT定量蛋白质组学研究(上海百趣生物提供)。KEGG分析揭示了几种丰富的OA相关通路,如ECM受体相互作用、TNF信号通路、细胞衰老和糖胺聚糖生物合成(图3 A)。火山图显示,分解代谢因子(MMP3和MMP13)、衰老标志物(P21)和炎症趋化因子(CCL2、CCL5和CXCL10)上调,合成代谢因子(aggrecan、COL2A1和SOX9)下调(图3 B)。先前的一项研究表明,SOX9缺乏导致健康软骨蛋白聚糖丢失,并导致创伤性OA后严重的软骨侵蚀。作者接下来重点关注SOX9是否是ADMA影响的核心蛋白。RT-PCR显示,DDAH1的缺失没有显著改变SOX9 RNA水平(图3 C)。然而,暴露于ADMA或DDAH1缺失的软骨细胞中,SOX9蛋白表达显著下调(图3 D和3 E)。
此外,免疫组织化学表明,关节注射PD 404182的小鼠(图3 F)或DDAH1fl/fl, Col2-CreERT2和DDAH1fl/fl, ACAN-CreERT2小鼠的软骨中SOX9的表达急剧下降(图3 G、 H)。此外,暴露于ADMA的细胞中SOX9的半衰期比对照细胞短,表明ADMA导致SOX9的不稳定性。MG132(一种蛋白酶体抑制剂)处理阻断了SOX9的降解,而氯喹(一种溶酶体抑制剂)则没有,这表明SOX9的降解依赖于蛋白酶体而不是溶酶体途径(图3 I、J)。此外,ADMA诱导的SOX9降解在过表达DDAH1的软骨细胞中部分逆转(图3 K)。值得注意的是,ADMA增加了泛素化SOX9的水平(图3 L)。总之,ADMA通过泛素-蛋白酶体途径触发SOX9降解。
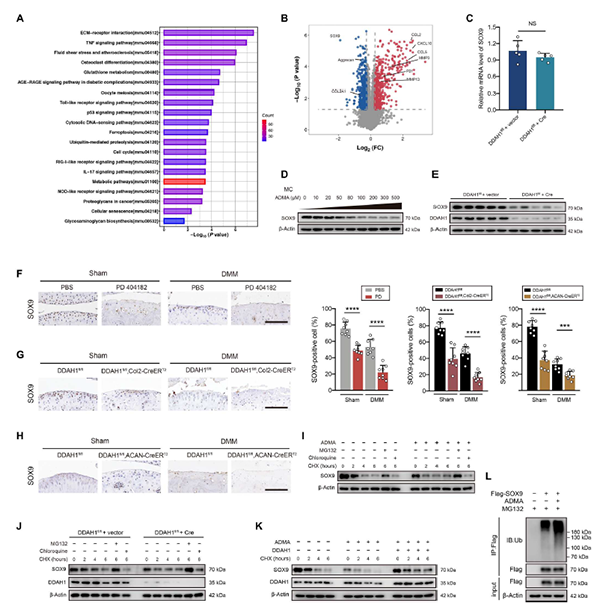
图3. ADMA通过泛素-蛋白酶体途径诱导SOX9降解
05ADMA阻断SOX9和USP7之间的相互作用
在证明ADMA通过泛素-蛋白酶体途径加速SOX9降解后,作者下一步的目标是确定ADMA如何影响SOX9水平。作者合成了生物素-ADMA,将其与软骨细胞培养液培养,质谱检测,结合UbiBrowser数据库,预测了SOX9相关E3泛素连接酶或去泛素化酶(Deubiqui-tinating enzymes, DUBs)特异性相互作用的蛋白质,发现DUB USP7可能参与其中(图4 A、B)。免疫沉淀结果显示USP7能够降低泛素化的SOX9。通过Western blotting验证了USP7和ADMA之间的相互作用。质谱结果显示ADMA与SOX9相互作用,Western blotting进一步证实了这一点。
那么,进一步探讨ADMA是否与这两种蛋白质直接结合,系列分子实验结果表明,ADMA能够与SOX9和USP7之间的相互作用区域结合,主要是阻止它们的结合。免疫共沉淀证实了SOX9和USP7之间的相互作用,而ADMA可以削弱这种相互作用(图4 C~J)。为了证实猜想准确性,抑制USP7后,ADMA不影响SOX9的表达和对SOX9的泛素化。这些结果证实了ADMA阻断USP7对SOX9去泛素化作用。
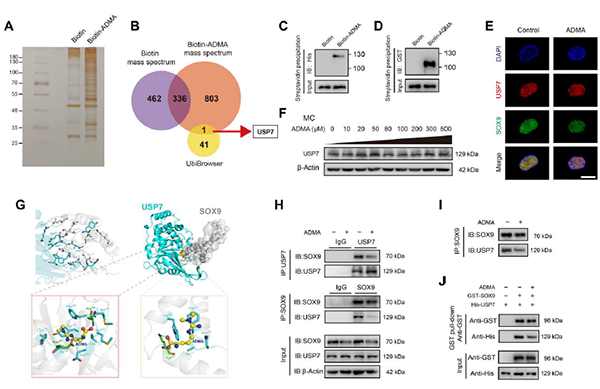
图4. ADMA阻断SOX9和USP7之间的相互作用
06滑液中的ADMA是一种潜在的OA诊断标志物
为了研究ADMA在人类滑膜液中是否增加,作者进行了回顾性研究(图5 A)。根据纳入标准,纳入350例OA患者(n = 114 in center1, n = 112 in center 2, and n = 124 in center 3),并根据Kellgren-Lawrence (KL)分级分为轻度、中度和重度3个阶段(图5 B)。考虑到OA是一种与年龄相关的退行性疾病,三个阶段的患者在性别、身高、体重和身体质量指数(BMI)方面没有明显差异,但年龄略有差异(图5 C)。和预期一样,与相对健康的患者相比,OA患者滑液中表现为主要ADMA增加,而SDMA没有表现出临床意义。严重OA患者滑液中ADMA水平明显高于中度OA患者(图5 D),表明ADMA可能与OA进展呈正相关。根据Pearson相关分析,滑液中的ADMA与膝关节社会评分(膝关节OA的临床评估评分)(图5 E)和最小内侧关节间隙宽度(x线测量关节间隙狭窄和评估OA的关键指标)呈负相关(图5 F)。此外,ADMA与年龄有轻微的正相关,与BMI无关(图5 G、H)。受试者工作特征(ROC)曲线显示,滑液ADMA能将OA患者与相对健康的患者区分开来,有利于OA的早期诊断,具有良好的敏感性和特异性;但是,不能鉴别晚期OA和早期OA(图5 I)。这些数据表明,滑液中的ADMA可能是OA诊断的潜在标志物。
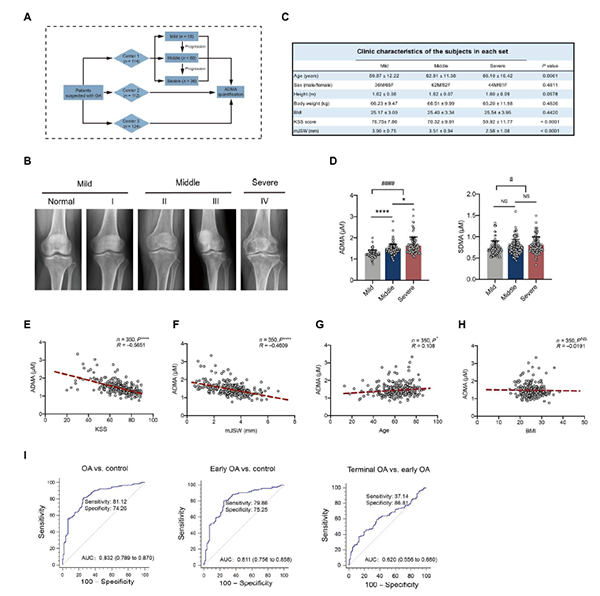
图5. ADMA在人类滑膜液中的变化结果
总结
本文中,研究团队在退化的软骨细胞中发现了新的生物标志物ADMA,ADMA的增加伴随着DDAH1的下调。在DDAH1的调节下,ADMA促进软骨细胞和软骨的退变与衰老,从而加速OA的进展,而不依赖于NOS/NO途径。相反,ADMA直接结合SOX9和USP7并阻断它们的相互作用区域,通过泛素-蛋白酶体途径促进SOX9降解。因此,靶向DDAH1可能为OA治疗提供新的方向。
文献下载链接:
https://pan.baidu.com/s/1ctg81ret7qNCex6Za63s7w
提取码:0000










