

文章标题:Integrative single-cell RNA sequencing and metabolomics decipher the imbalanced lipid-metabolism in maladaptive immune responses during sepsis
发表期刊:Frontiers in Immunology
影响因子:7.3
客户单位:中国人民解放军陆军特色医学中心
百趣提供服务:发现代谢组学HD MIX(现已更新为新一代代谢组学 NGM)
对感染不受控制的免疫反应引起的脓毒症可发展为致命的器官衰竭,但现有的生物标志物不能用于脓毒症预后预测。因此,需要进一步研究脓毒症的发病机制,并确定更敏感和特异的治疗靶点。
代谢和免疫反应通常发生在脓毒症早期,可以反映后期器官衰竭的严重程度。了解脂质代谢和免疫细胞浸润的变化,有助于从药理学角度确定更多潜在的治疗靶点,以调节脓毒症期间的脂质代谢。在本研究中,作者通过机器学习算法鉴定了脓毒症中新的脂质代谢相关关键基因,并通过scRNA-seq分析研究了这些关键基因在免疫细胞浸润特征中的作用。通过代谢组学确定与这些关键基因最相关的代谢产物,旨在发现脓毒症可能的治疗干预措施。
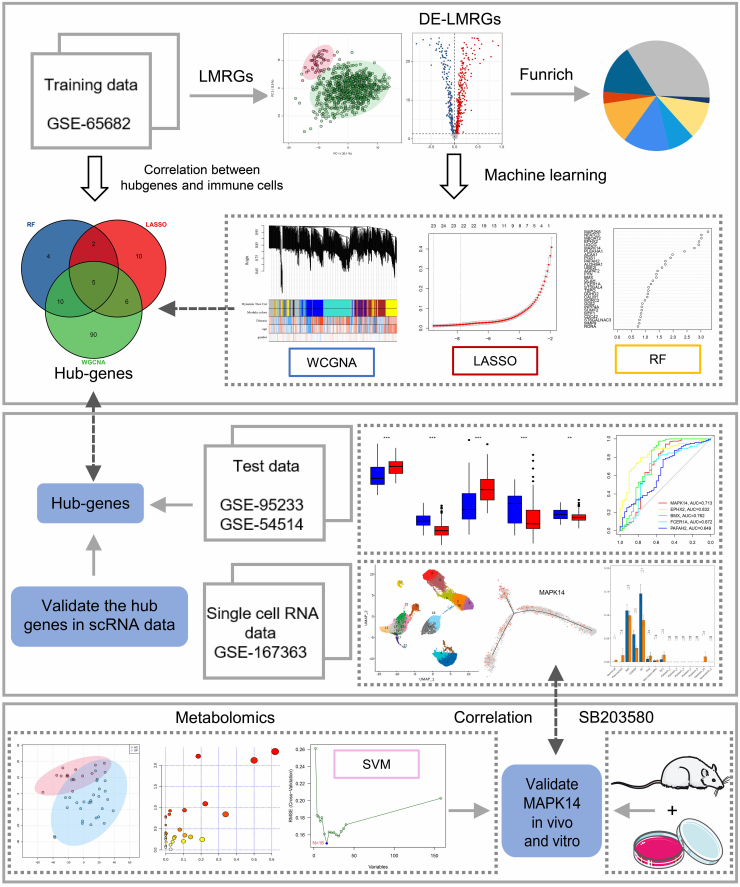
图1 技术路线
3.1 通过多种机器学习算法筛选脓毒症中与脂质代谢相关的hub基因
数据集GSE-65682作为训练集,用于获得关键基因,数据集GSE95233和GSE54514合并为验证集,验证关键基因的mRNA表达和诊断性能。使用“limma”R包,筛选出脂质代谢相关基因LMRGs。运用加权基因共表达网络分析(Weighted correlation network analysis, WGCNA)分析发现可能的脓毒症基因模块,并确定了与脓毒症相关性最高的基因模块。建立LASSO逻辑回归和随机森林(RandomForest, RF)模型,分别筛选了23和21个脂质代谢相关差异基因(differentially expressed lipid metabolism-related genes, DE-LMRGs)。
通过3种方法WGCNA、LASSO和RF的交叉,确定了5个关键基因(MAPK14、EPHX2、BMX、FCER1A和PAFAH2)(图3 H)。采用受试者工作特征曲线(receiver operating characteristic curve, ROC)分析分别在训练队列GSE65682和合并验证队列GSE95233和GSE54514中验证这5个关键基因,结果表示它们具有较好的预测能力。
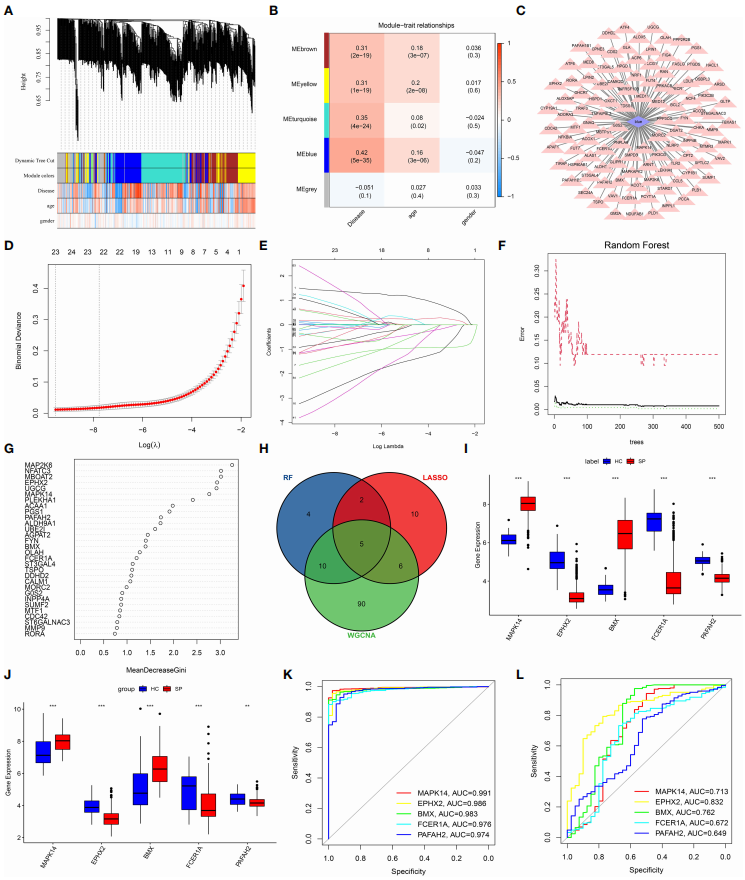
图2 通过综合策略筛选DE LMRG
3.2 脂质代谢相关的hub基因可能影响脓毒症免疫细胞浸润
为了研究脓毒症患病组(Septic Patients, SP)和健康组(Healthy Control, HC)之间的免疫细胞浸润的差异。通过免疫浸润分析工具CIBERSORT分析训练数据集GSE65682的每个样本中的免疫细胞比例比较(图3 A)。并发现2个关键基因(MAPK14和BMX)的表达量与M1巨噬细胞、M2巨噬细胞、单核细胞和活化的肥大细胞之间存在正相关。单样本基因集富集分析(Single Sample Gene Set Enrichment Analysis, ssGSEA)算法也验证了上述结果(图3 C、D),表明脓毒症中存在免疫抑制微环境,这可能为免疫治疗提供新的策略。
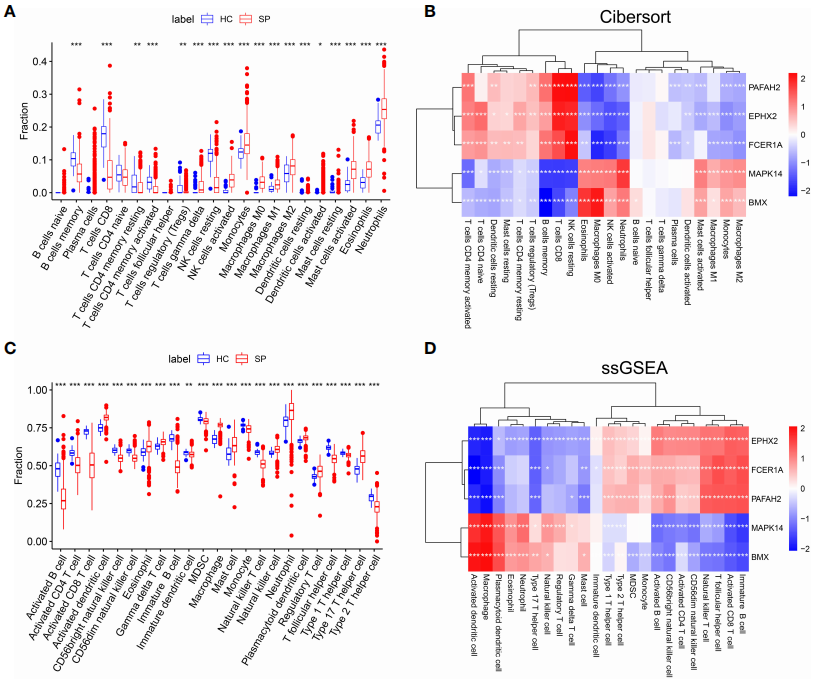
图3 GSE65682中免疫细胞浸润情况及相关性分析
3.3 MAPK14参与脓毒症单核细胞分化
为了在单细胞水平上进一步研究这些关键基因的免疫细胞图谱,通过获取38562个高质量的单细胞数据,使用SynEcoSys数据库(单细胞数据库)来确定差异表达基因(Differentially Expressed Genes, DEGs)中每个聚类的细胞类型;通过UMAP(降维算法)获得了7个细胞簇(浆细胞样树突状细胞、红细胞、中性粒细胞、血小板、单核细胞、T细胞和B细胞)(图4 A)。并鉴定了脓毒症中免疫细胞的亚型,五种T细胞亚群(图4 C)、三个B细胞亚群(图4 D)、三种单核细胞亚群(图4 E)。
每个亚群中5个关键基因(PAFAH2、MAPK14、EPHX2、FCER1A和BMX)的表达在SP和HC之间差异显著(图4 G),表明在脓毒症患病期间,脂质代谢相关基因可能在大多数免疫细胞亚群中发挥关键作用。
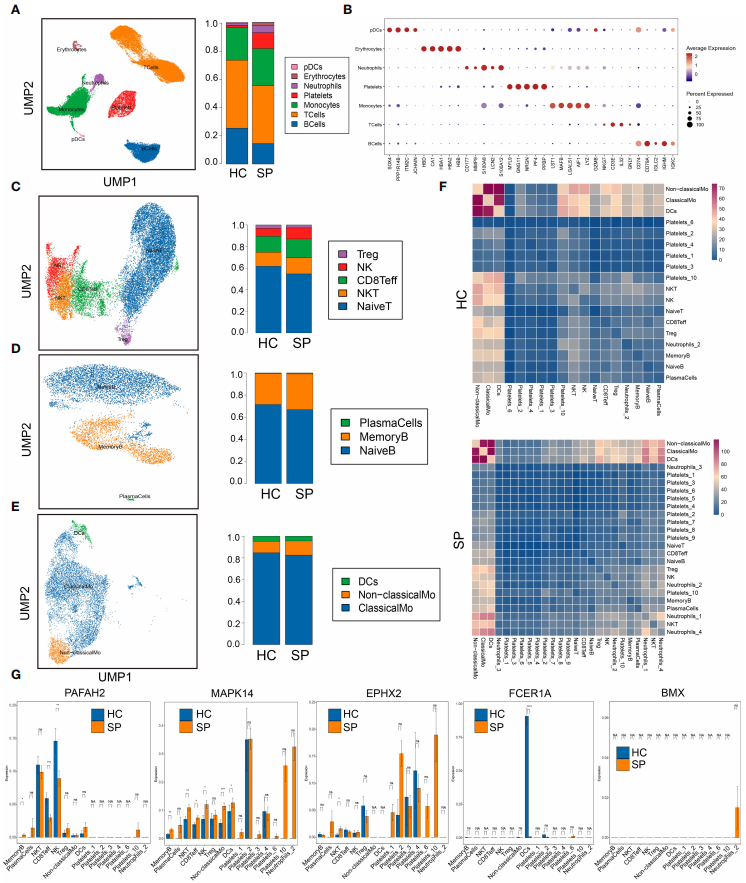
图4 败血症患者外周血单个核细胞(PBMC)的单细胞基因表达分析
通过单核细胞的轨迹和拟时序分析(基于单细胞测序数据,通过特定算法来模拟研究细胞不断变化的过程,就称之为“拟时序分析”)进一步研究了细胞分化。经典单核细胞首先发展为非经典单核,然后进一步发展为树突状细胞(Dendritic cells, DCs)。在SP中检测到细胞的3种状态,在HC中只发现状态1(图5A-D)。关键基因MAPK14同时存在于所有状态中(图5E)。基于GO分析,鉴定了SP中非经典单核细胞和非经典单核细胞之间的DEGs的生物学过程,包括体液免疫反应、突触修剪和免疫球蛋白介导的免疫反应(图5 I、J)。通过基因集变异分析(Gene set variation analysis, GSVA),检测到非经典单核细胞中上调的途径是B细胞受体信号通路、氧化磷酸化等(图5 K)。
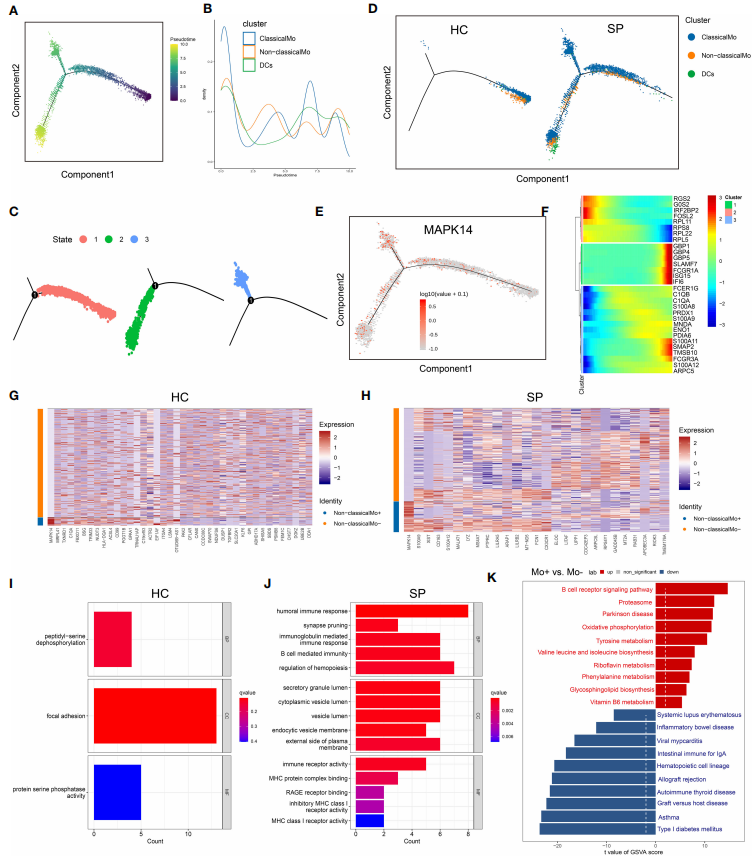
图5 免疫细胞的轨迹和拟时序分析
3.4 MAPK14在脓毒症患者、大鼠和LPS诱导的心肌细胞中的作用
MAPK14是唯一参与脓毒症中单核细胞分化所有状态的关键基因。为了验证MAPK14的作用,通过UHPLC-MS系统进行代谢组学研究,主成分分析(Principal Component Analysis, PCA)得分图表明,两组样本具有显著差异(图7 A)。正交偏最小二乘判别分析(orthogonal partial least squares-discriminant analysis, OPLS-DA),用于两组的模式识别,并探索差异表达的代谢物(differentially expressed metabolites, DEM),共获得449个DEMs。DEMs在苯丙氨酸代谢、苯丙氨酸、酪氨酸和色氨酸生物合成以及丙酮酸代谢途径中显著富集(图6 F)。此外,支持向量机(support vector machines, SVM)共鉴定出16种关键代谢产物(图6 G)。通过进一步分析了hub代谢产物与已鉴定的hub基因之间的相关性,发现这些关键代谢产物均与MAPK14和BMX呈正相关,与FCER1A、PAFAH2、EPHX2呈负相关(图6 H)。
为了探讨MAPK14抑制剂对脓毒症大鼠心肌功能的影响,使用体外心肌脓毒症模型,对脓毒症大鼠模型使用MAPK14抑制剂SB203580给药,证实了SB203580给药对MAPK14表达的有效作用。
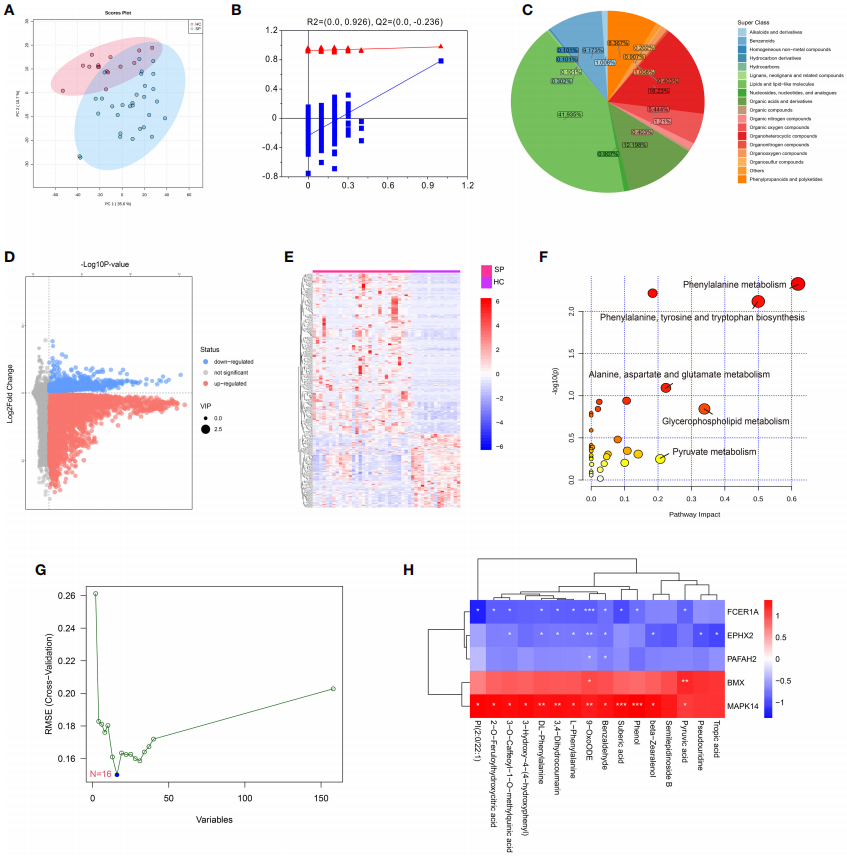
图6 健康对照组和败血症患者的代谢组学分析
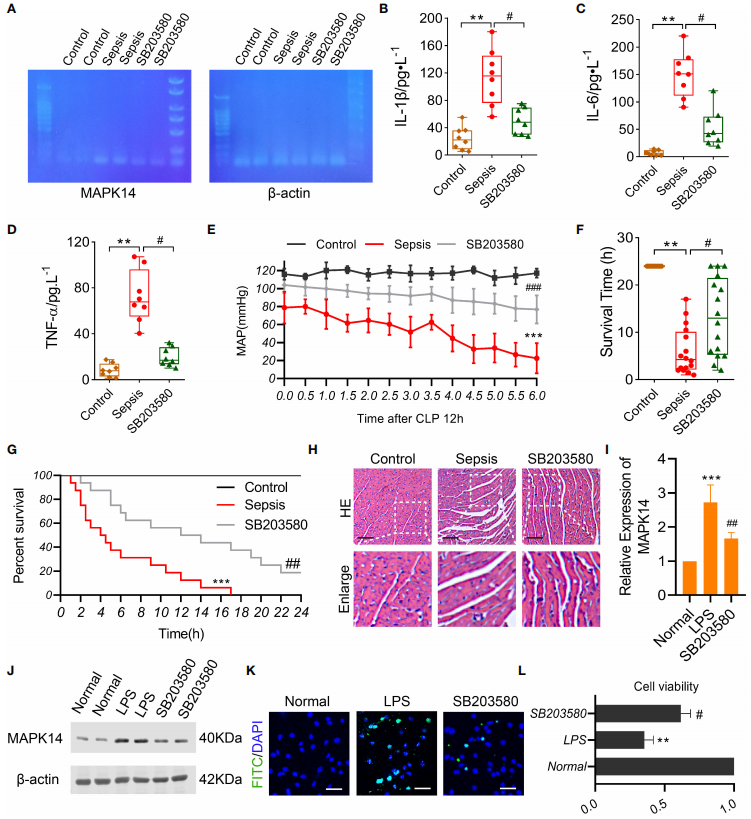
图7 MAPK14在脓毒症大鼠和LPS诱导的心肌细胞中的作用
在本研究中,通过机器学习算法确定了5个与脂质代谢相关的关键基因(MAPK14、EPHX2、BMX、FCER1A、PAFAH2),它们有可能用于对脓毒症患者进行诊断和治疗的关键靶点。单细胞RNA图谱显示,LMRGs可能在脓毒症期间的免疫系统中发挥关键作用。
抑制MAPK14对脓毒症的保护作用表明,这些脂质代谢关键基因在脓毒症患者的预后预测和精确治疗方面具有巨大潜力。









