

文章标题:VCP downstream metabolite glycerol-3-phosphate (G3P) inhibits CD8+T cells function in the HCC microenvironment
期刊:Signal Transduction and Targeted Therapy
影响因子:40.8
合作单位:中国科学技术大学第一附属医院
百趣提供服务:新一代代谢组学 NGM
肝细胞癌(Hepatocellular carcinoma, HCC)是全球癌症相关死亡的第三大原因,其治疗选择有限,尤其是对于晚期患者。免疫检查点阻断(Immune checkpoint blockade, ICB)疗法在HCC治疗中显示出潜力,但响应率较低,不足20%。肿瘤微环境(Tumor microenvironment, TME)的免疫抑制特性是导致治疗效果不佳的关键因素之一。在TME中,CD8+T细胞的功能受损,限制了其抗肿瘤能力。然而,导致这种功能障碍的分子机制尚未完全明确。2025年1月24日,中国科学技术大学刘连新教授团队在Signal Transduction and Targeted Therapy 上在线发表题为“VCP downstream metabolite glycerol-3-phosphate(G3P) inhibits CD8+T cells function in the HCC microenvironment”的研究论文,确定含缬氨酸蛋白(Valosin-containing protein, VCP)是肝细胞癌(HCC)中CD8+T细胞抑制的关键调节因子。
研究者发现,含缬氨酸蛋白(Valosin-containing protein, VCP)在HCC中通过抑制CD8+T细胞的激活、增殖和细胞毒性能力,显著增强了TME的免疫抑制特性。实验中,VCP的敲除(Vcp depletion)在免疫健全的C57BL/6小鼠模型中显著抑制了肿瘤生长,而在免疫缺陷的裸鼠模型中效果不明显,表明VCP对肿瘤生长的影响主要通过免疫系统发挥作用(图1a、b)。进一步的实验表明,在VCP过表达的小鼠模型中,肿瘤发生更早、肿瘤体积更大、生存期更短(图1d、e、f、g)。单细胞RNA测序分析显示,VCP过表达组中T细胞亚群数量减少,尤其是效应CD8+T细胞(图1h、i)。此外,免疫耗竭实验表明,CD8+T细胞的缺失几乎消除了VCP敲除对肿瘤生长的抑制作用(图1j、k),证实了效应CD8+T细胞在VCP介导的肿瘤生长中的关键作用。
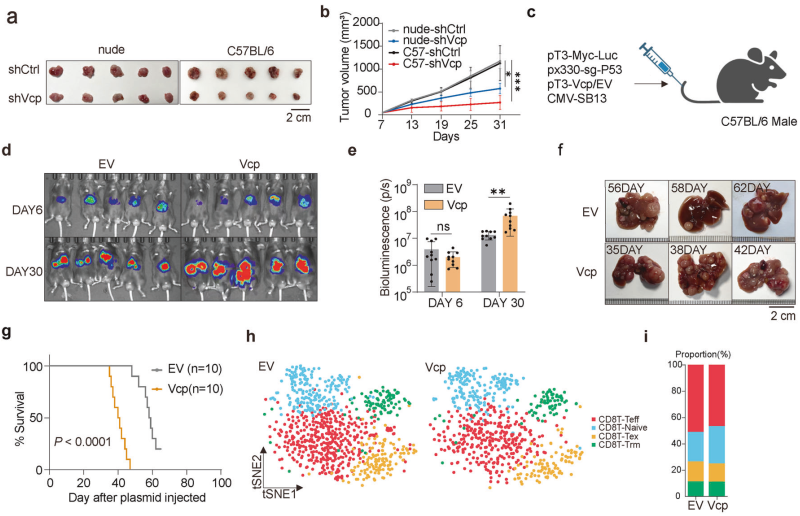
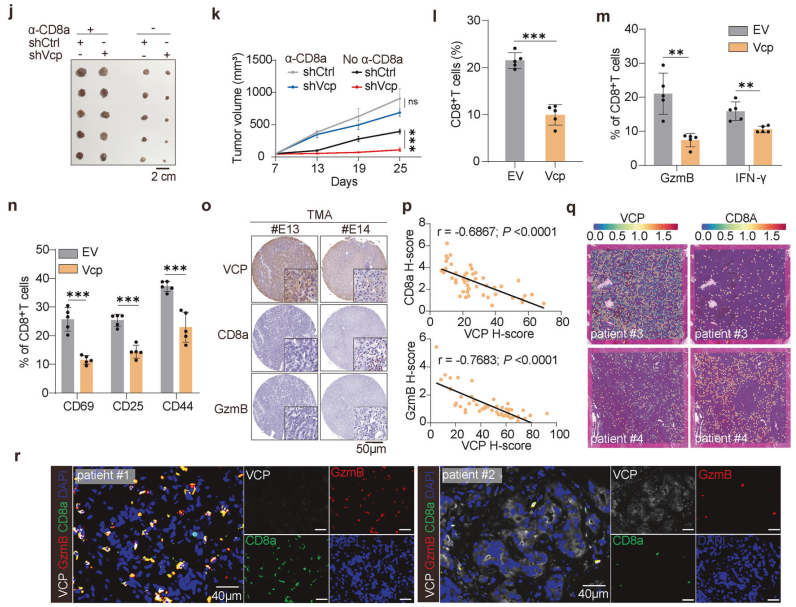
图1. VCP通过代谢物介导的机制抑制CD8+T细胞功能
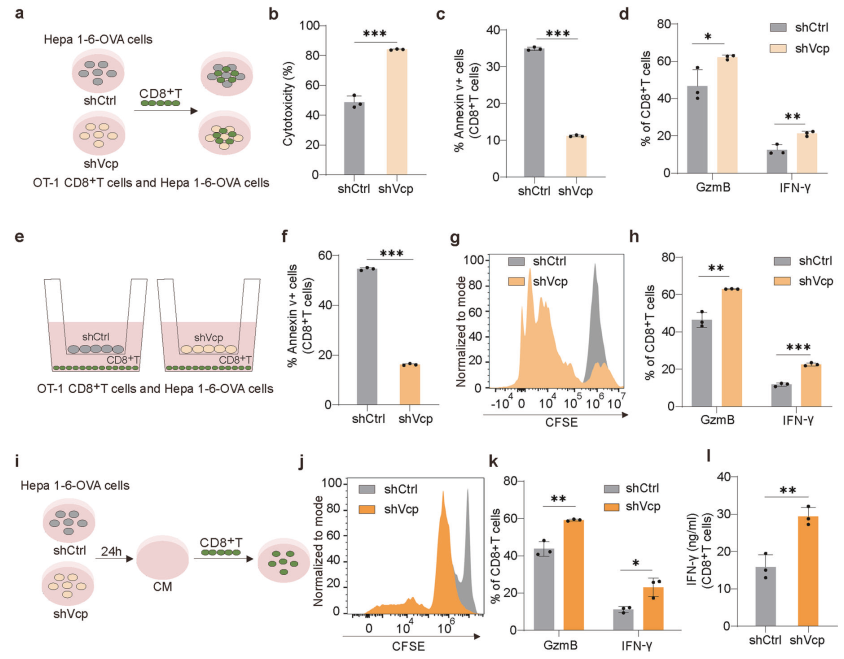
为了探究VCP的作用机制,研究者进行了共培养实验,发现VCP的缺失增强了CD8+T细胞的细胞毒性、减少了CD8+T细胞的凋亡,并上调了细胞因子GzmB和IFN-γ的水平(图2b、c、d)。进一步的实验表明,VCP通过分泌物抑制CD8+T细胞的功能。通过将肿瘤细胞的条件培养基(CM)分为>3 kDa(富含蛋白质)和<3 kDa(富含代谢物)两部分,研究者发现代谢物部分对CD8+T细胞功能的抑制作用更为显著(图2n、o)。这表明VCP通过代谢物介导的机制抑制CD8+T细胞的功能。
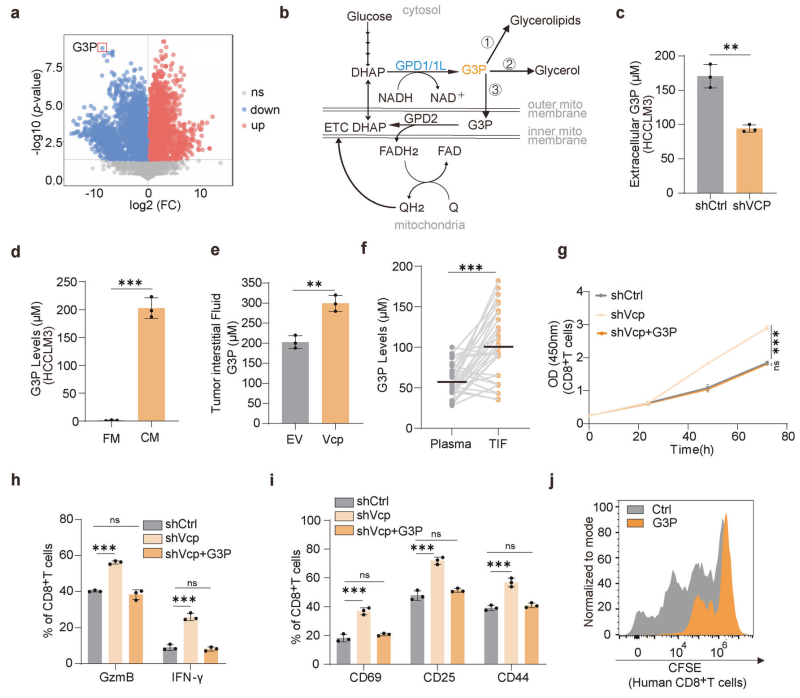
代谢组学分析显示,VCP缺失的HCC细胞培养基中G3P(Glycerol-3-phosphate)水平变化最为显著(图3a)。G3P是脂质合成、氧化磷酸化和糖酵解的中心节点(图3b)。实验验证了G3P在VCP缺失的细胞内外水平均降低(图3c、d),并且在HCC患者肿瘤组织的间质液中G3P浓度高于匹配的血浆(图3f)。此外,G3P的添加能够抵消VCP缺失对CD8+T细胞的促进作用,包括增殖、细胞因子表达和激活(图3g、h、i)。这些结果表明,VCP通过下游代谢物G3P抑制CD8+T细胞的功能。
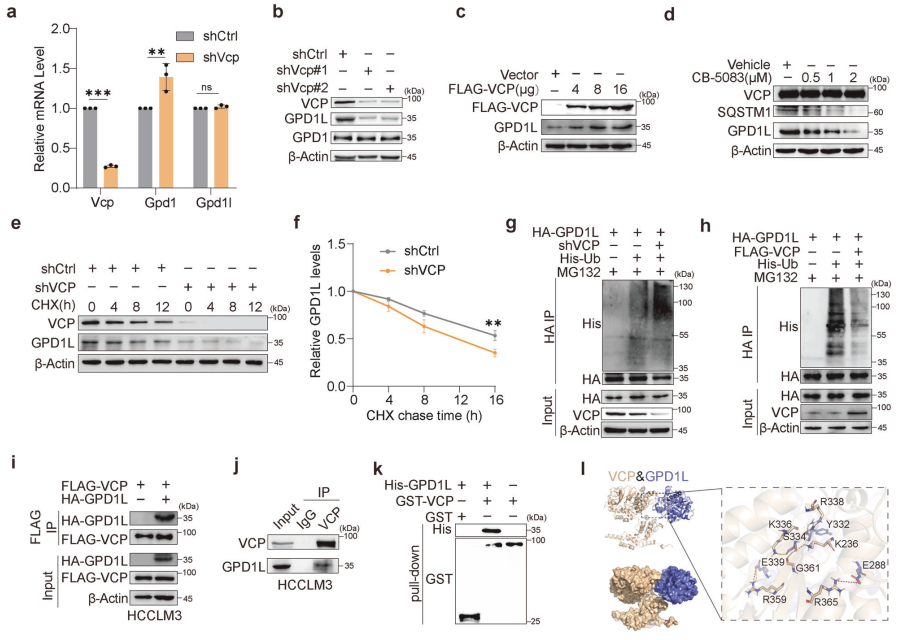
研究者进一步探究了VCP如何调节G3P的积累。实验发现,VCP的缺失上调了Gpd1l的mRNA水平,但对Gpd1的mRNA水平无影响(图4a)。蛋白质检测显示,VCP的缺失降低了GPD1L蛋白水平,但对GPD1蛋白水平无影响(图4b)。此外,GPD1L的敲低显著降低了细胞内外的G3P水平,而GPD1的敲低则无此效果(补充图5a-c)。这些结果表明,HCC中的G3P主要依赖于GPD1L的表达。进一步的实验表明,VCP通过泛素-蛋白酶体途径稳定GPD1L,并且VCP与GPD1L直接相互作用(图4i、j、k)。分子对接模拟和免疫荧光染色进一步证实了VCP与GPD1L的相互作用(图4l、m)。这些结果表明,VCP通过稳定GPD1L来促进G3P的积累,从而抑制CD8+T细胞的功能。
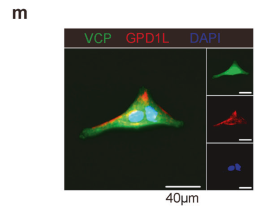
研究者发现,G3P能够抑制CD8+T细胞的激活和效应功能,其机制是通过抑制T细胞受体(TCR)信号通路中的关键蛋白LCK(图5a、b、c)。G3P处理的CD8+T细胞显示出TCR信号通路中关键蛋白的磷酸化水平降低,包括LCK(Y394)、ZAP70、LAT和PI3K(图5c)。此外,G3P处理的CD8+T细胞中TCR信号微簇的形成减少(图5d-g)。这些结果表明,G3P通过抑制LCK信号通路抑制CD8+T细胞的激活和效应功能。
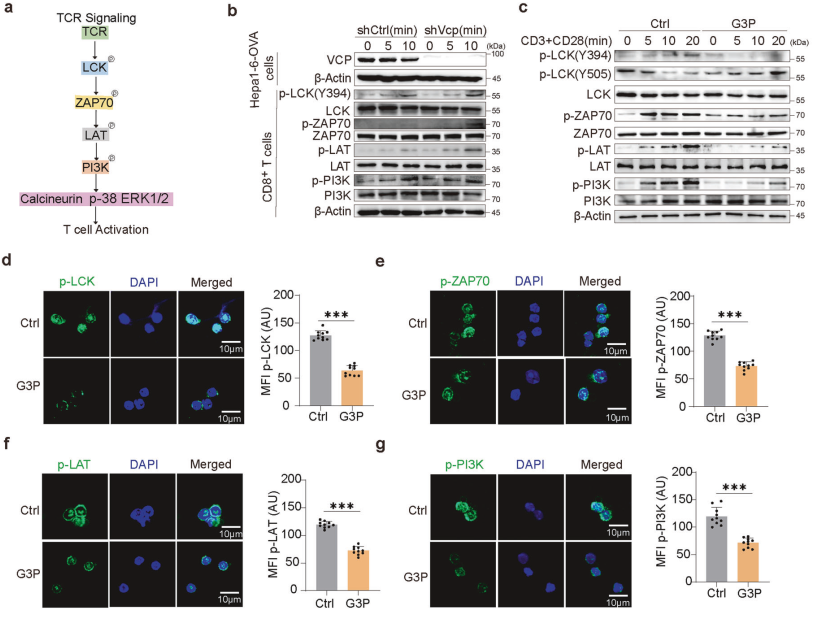
图5. VCP在HCC中维持GPD1L的稳定性以积累G3P
实验表明,G3P能够剂量依赖性地抑制LCK的Y394位点的磷酸化,同时增强Y505位点的磷酸化(图6a、b)。进一步的实验表明,G3P通过与LCK的AA330-509区域结合来抑制LCK的活性(图6h-o)。这些结果揭示了G3P通过直接与LCK相互作用并抑制其活性的分子机制。
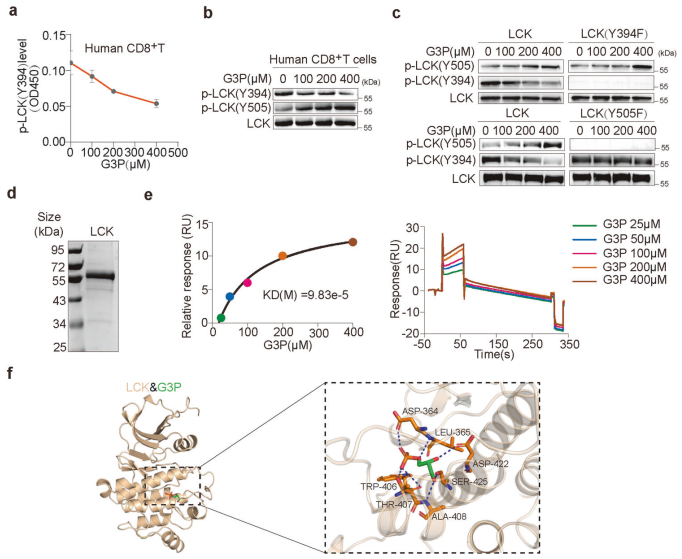
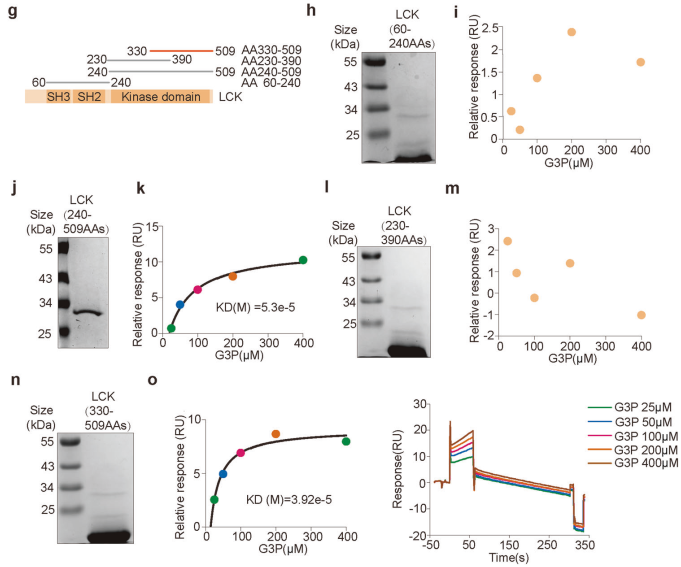
图6. G3P通过LCK信号抑制CD8+T细胞
研究者提出了靶向VCP与抗PD1治疗联合应用的策略,以重塑HCC的TME。实验结果表明,VCP抑制剂CB-5083与抗PD1治疗的联合应用显著抑制了HCC小鼠模型中的肿瘤生长,并且没有导致小鼠体重下降(图7b、c)。流式细胞术分析显示,联合治疗增强了CD8+T细胞的浸润、效应功能和激活(图7d-f)。此外,联合治疗组的肿瘤间质液中G3P水平显著降低(补充图8g)。这些结果表明,靶向VCP与抗PD1治疗的联合应用能够显著改善HCC的免疫微环境,抑制肿瘤生长。
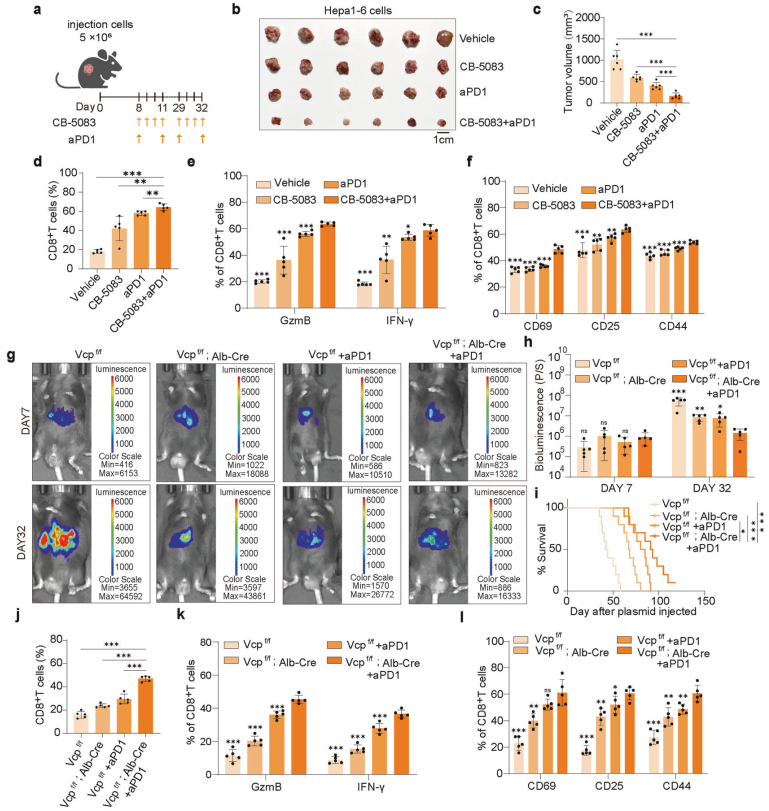
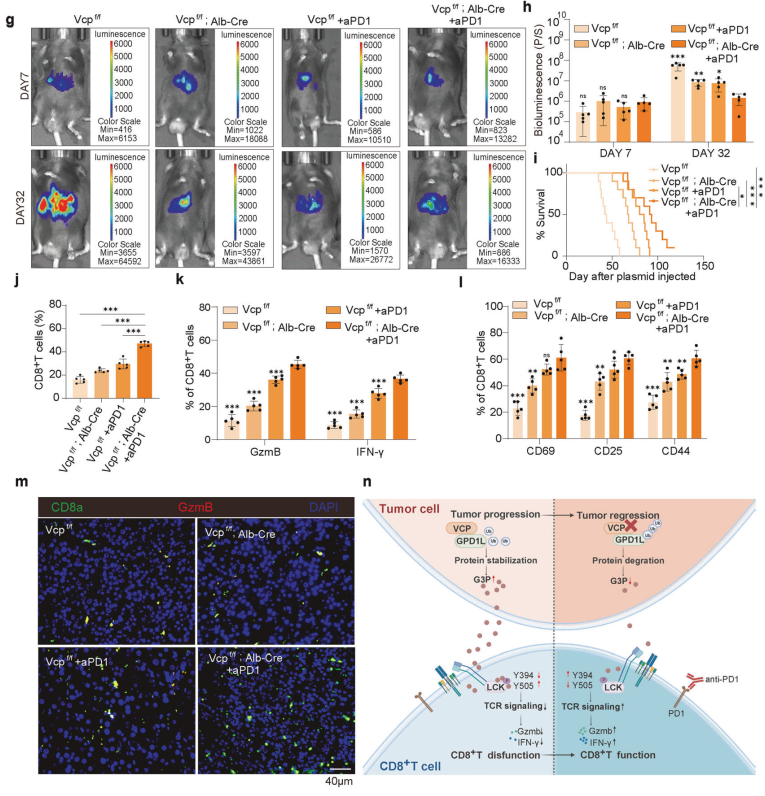
本研究揭示了VCP在HCC中通过稳定GPD1L促进G3P积累,进而抑制CD8+T细胞功能的新机制。VCP的抑制能够增强抗PD1治疗的效果,为HCC的免疫治疗提供了新的策略。研究结果不仅揭示了VCP在HCC中的重要作用,还为开发新的联合治疗方案提供了理论依据。未来的研究将进一步探索VCP-G3P轴在其他癌症类型中的应用,并评估其在临床治疗中的潜力。









