
文章标题:Mycobacterium tuberculosis suppresses host DNA repair to boost its intracellular survival
客户单位:同济大学附属上海市肺科医院
期刊:Cell Host & Microbe
影响因子:30.3
百趣提供服务:600MRM
结核分枝杆菌(Mycobacterium tuberculosis, Mtb)通常会触发宿主先天和适应性免疫细胞从而限制细菌生长。肺泡巨噬细胞首先对结核分枝杆菌感染产生应答,可通过吞噬作用、吞噬体-溶酶体融合、细胞凋亡和自噬等一系列机制消灭细胞内细菌。然而,作为一种成熟的细胞内病原体,Mtb通过进化毒力因子(如细胞壁成分和分泌的蛋白质和代谢物)来逃避或抑制宿主的抗菌机制,并促进细胞内感染成功进行,从而响应这些宿主的防御策略。
毒性强的结核分枝杆菌菌株引起DNA双链断裂(double-strand breaks, DSBs)并诱导基因组不稳定。Mtb在分泌系统的帮助下分泌超过300种分泌因子。Mtb SecA2通路分泌的效应器导致DSBs,Mtb Rv2346c(ESAT-6蛋白家族成员)通过促进氧化应激诱导巨噬细胞DNA损伤。考虑到在Mtb感染的巨噬细胞或小鼠肺组织中持续存在的DSBs导致修复效率低下,本研究假设Mtb通过其细胞内分泌蛋白干扰宿主DNA修复过程。
1、UreC是宿主DNA修复抑制剂
结核分枝杆菌H37Rv作为DNA损伤和修复的生物标志物,显著诱导H2AX 丝氨酸-139磷酸化(γH2AX),但高温或利福平(抗结核分枝杆菌的一线药物)失活显著抑制了H37Rv对 γH2AX的诱导(图1 A、B)。检测81个Mtb分泌蛋白对两种DNA DSB修复途径——同源重组(homologous recombination, HR)和非同源末端连接(nonhomologous end joining, NHEJ)报告蛋白的影响,发现脲酶C (Urease C, UreC) (Rv1850)抑制HR和NHEJ (图1 C、D)。在Mtb感染的巨噬细胞中,UreC的缺失显著降低了γH2AX水平的诱导或γH2AX与DSBs共定位(图1 E),Mtb感染的巨噬细胞中UreC的缺失稳定了基因组(图1 F、G)。
在HEK293T细胞(常被称作“工具细胞”,实验中常使用它来进行慢病毒包装生产及滴度测定,细胞转染,条件培养基制作,蛋白表达验证等试验)或巨噬细胞中,单独过表达UreC并不会引起DNA损伤。在感染H37Rv的原代小鼠腹膜巨噬细胞中观察到微核显著增加,这是基因组不稳定的标志,但H37RvΔUreC的巨噬细胞的微核产生频率远低于感染野生型H37Rv的巨噬细胞(图1 H、I)。

图1 UreC是一种宿主DNA修复阻断剂
2、UreC促进Mtb在细胞内存活
H37RvΔUreC的体外生长速度与野生型H37Rv无显著差异。UreC缺失显著降低了小鼠肺组织的组织病理学改变,导致其免疫细胞浸润减少,炎症病变减少,肺部的细菌负荷降低,而H37RvΔUreC与野生型UreC的互补可恢复这种损伤(图2 A-D)。集落形成单位(colony-forming unit, CFU)测定结果表明,H37Rv和H37RvΔUreC在感染后24小时后,H37RvΔUreC在细胞内数量显著减少(图2 E-H)。
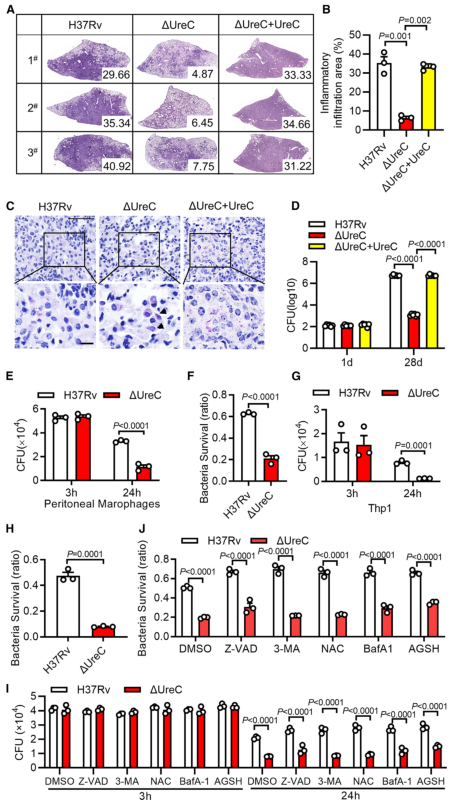
图2 UreC促进Mtb细胞内存活
3、UreC与RUVBL2互作
免疫沉淀和质谱分析鉴定UreC是RuvB样蛋白2 (RuvB-like protein 2, RUVBL2)(RUVBL蛋白参与转录调控、DNA损伤修复、细胞周期控制和应激适应)的相互作用蛋白(图3 A、B)。纯化蛋白的表面等离子体共振(surface plasmon resonance, SPR)实验显示,与RUVBL1(RUVBL2结合蛋白)相比,RUVBL2与UreC的结合亲和力更强(图3 C)。
用特异性抑制剂或小干扰RNA (small interfering RNA, siRNA)阻断RUVBL2,可减弱UreC介导的H37Rv诱导的H37Rv感染巨噬细胞中γH2AX的增强(图3 D、E)。RUVBL2与RAD51(RAD51 重组酶是同源重组 (HR) 的关键效应子)相互作用,通过稳定RAD51病灶形成介导HR修复。coIP分析显示,RUVBL1/2在HEK293T细胞中与RAD51相互作用,但UreC的共表达阻碍了RUVBL1/2与RAD51的相互作用(图3 F)。
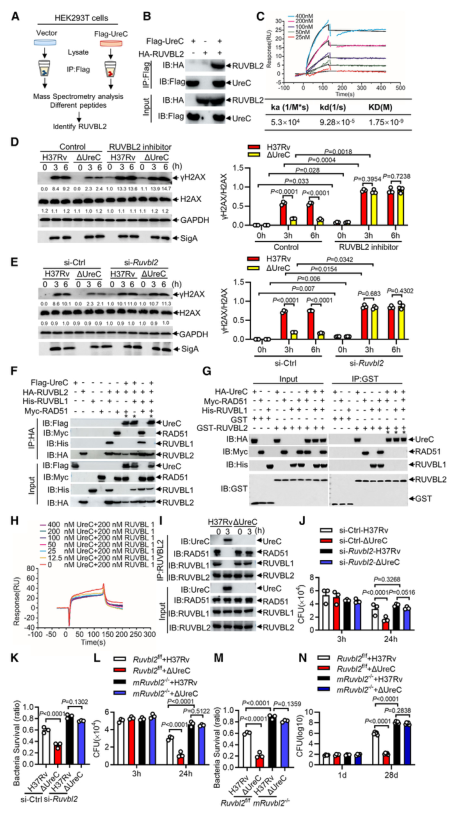
图3 UreC与RUVBL2相互作用,消除RUVBL2与RAD51复合物的形成
4、UreC通过IFN-β促进泡沫细胞形成
感染H37RvΔUreC的巨噬细胞中,Ifnb和IFN刺激基因(包括Cxcl11、Ifit1bl1、Irf7和Isg15)的mRNA水平远低于感染H37Rv的巨噬细胞。UreC的缺失也显著降低了H37Rv感染巨噬细胞中IFN-β的产生(图4 A)。ELISA结果显示,UreC还能提高H37Rv感染小鼠肺组织或血清中IFN-β蛋白水平(图4 B、C)。
cGAS是Mtb胞质DNA传感器,能够产生2’3‘-环GMP-AMP (2',3'-cyclic GMP-AMP, cGAMP),进而激活STING诱导IFN-β。敲除Cgas或Sting均可显著降低Mtb诱导的Ifnb表达或IFN-β的产生(图4 D、E)。
Mtb感染的巨噬细胞积累脂滴,可作为细胞内杆菌的营养来源。本研究发现H37Rv促进泡沫细胞(泡沫细胞是吞噬大量脂肪的巨噬细胞或平滑肌细胞)形成,增加中性脂质含量,而UreC的缺失显著减少了H37Rv感染巨噬细胞中脂滴的积累(图4 H、I)。
泡沫细胞的形成主要是几种清道夫受体(scavenger receptor)(是吞噬细胞表面的一组异质性分子,至少以6种不同的分子形式存在)介导的。UreC的缺失导致清道夫受体A1 (scavenger receptor-A1, SR-A1)的表达明显降低(图4 J)。特异性siRNA抑制SR-A1的表达可消除Mtb H37Rv诱导的脂滴积聚,同时也取消了ΔUreC对脂滴积聚的抑制作用(图4 K、L)。
I 型IFN暴露会引发胆固醇摄取、脂质积累和泡沫细胞形成。IFN-β处理显著增强了未被感染的巨噬细胞和H37Rv感染巨噬细胞的泡沫细胞形成,消除了ΔUreC介导的对H37Rv诱导的脂滴积聚的抑制(图4 M、N)。与此一致的是,IFN-β缺乏显著降低了H37Rv诱导的脂滴积聚,并抵消了ΔUreC对感染原代小鼠腹腔巨噬细胞脂滴积聚的抑制作用(图4 M、N)。此外,IFN-β蛋白暴露诱导了原代小鼠腹膜巨噬细胞中SR-A1的表达,并消除了ΔUreC介导的对SR-A1表达的抑制(图4 O)。
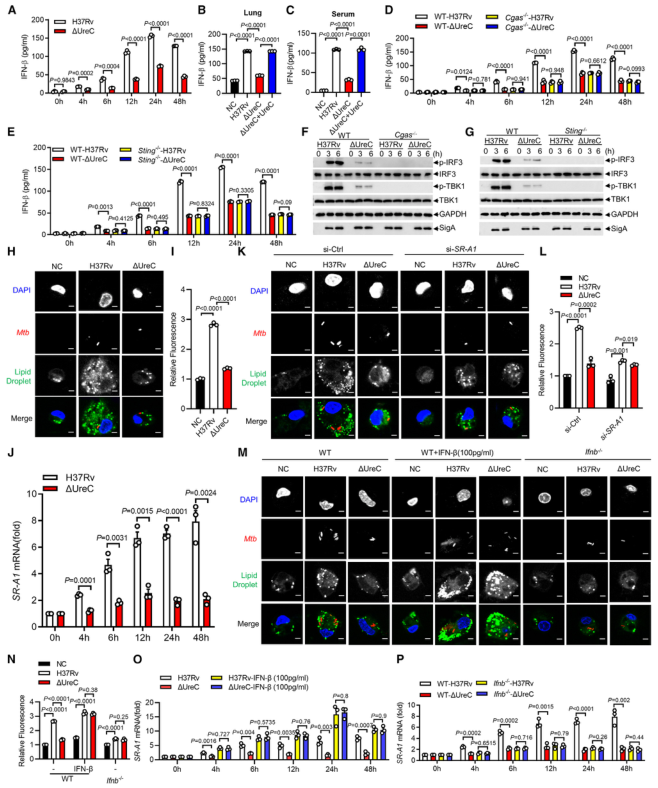
图4 UreC通过IFN-β促进泡沫细胞形成
5、UreC通过IFN-β促进结核分枝杆菌存活
使用增加浓度的IFN-β处理巨噬细胞,发现IFN-β增加了H37Rv和ΔUreC感染的巨噬细胞中Mtb的细胞内存活率,并缩小了细胞内细菌负荷的差异,下调或敲除Ifnb仅在感染H37Rv的巨噬细胞中导致细菌载量降低,而在感染H37RvΔUreC的巨噬细胞中则没有(图5 A、D)。与此一致的是,Ifnar1、Stat1或Stat2的缺失也抑制了感染小鼠腹膜中H37Rv的细菌载量,但对H37RvΔUreC没有作用(图5 E、F)。用特异性抑制剂或siRNA抑制SRA1可显著降低巨噬细胞中H37Rv的细胞内存活,但对H37RvΔUreC没有影响(图5 G-J)。
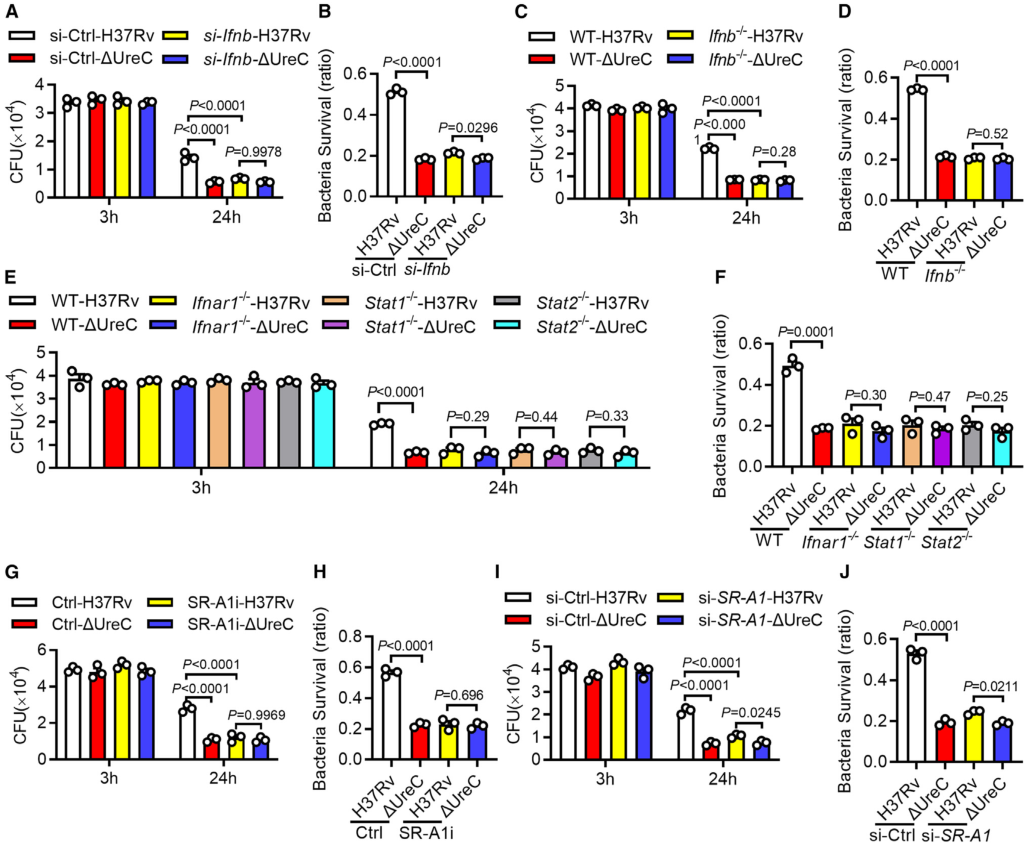
图5 UreC通过IFN-β途径促进结核分枝杆菌的细胞内存活
6、UreC依赖于它的脲酶活性
Mtb UreC可以催化尿素水解生成氨和氨基甲酸酯,导致整体pH升高。事实上,UreC的缺失降低了H37Rv感染巨噬细胞的胞质pH值,表明UreC确实具有碱化作用。对脲酶进行结构分析显示,两个组氨酸残基在协调活性位点的两个镍离子方面很重要,这两个残基(H253A和H279A)在Mtb UreC中也是保守的。与UreC互补,感染H37RvΔUreC的巨噬细胞降低的胞浆pH升高,而与其两个脲酶缺陷突变体(H253A或H279A)互补却没有此效果(图6 A)。
H37RvΔUreC与UreC互补后的生长与H37Rv在感染巨噬细胞中的生长相似,而与其两个脲酶缺陷突变体(H253A和H279A)互补后无明显效果(图6 B、C)。与UreC互补也恢复了受感染的原代小鼠腹膜巨噬细胞中Mtb诱导的DNA损伤反应(DNA damage responses, DDRs)(图6 D、E)。
进行coIP实验发现,在HEK293T细胞中添加NH4Cl增强了UreC和RUVBL2之间的相互作用,但乙酸降低了它们之间的相互作用(图6 F、G)。在coIP实验中,只有野生型UreC与RUVBL2相互作用(图6 H)。NH4Cl的加入挽救了UreC (H253A)或UreC (H279A)与RUVBL2的相互作用,表明UreC和RUVBL2之间的相互作用依赖于UreC脲酶活性介导的胞质pH升高(图6 H)。
使用野生型H37Rv或H37Rv (ΔUreC + UreC)以及H37Rv (ΔUreC)或H37Rv (ΔUreC + H253A/H279A)感染对RUVBL1/2与RAD51之间的相互作用的影响也证明了上述结论(图6 I)。
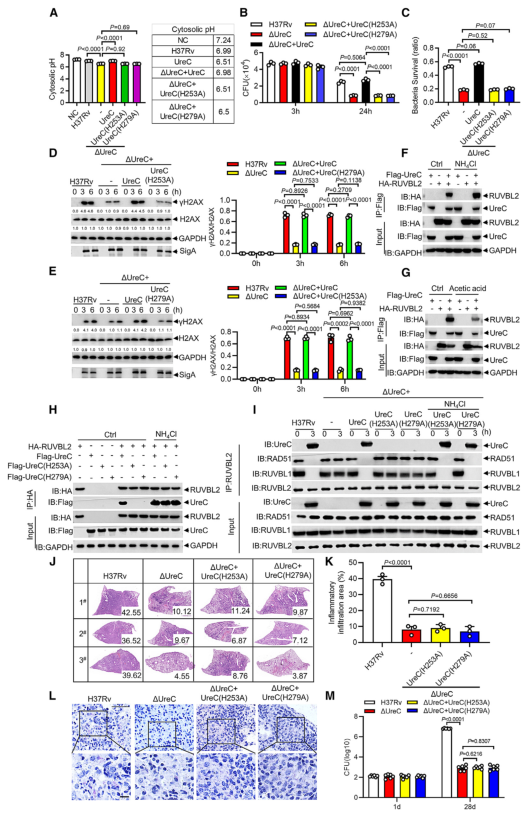
图6 UreC依赖于它的脲酶活性
7、抑制UreC可促进分枝杆菌的清除
脲酶抑制剂的一个主要类别是羟肟酸衍生物,如乙酰羟肟酸(acetohydroxamic acid, AHA)。AHA明显抑制巨噬细胞中H37Rv的生长,而不抑制H37RvΔUreC的生长(图7 A、B)。
本研究通过斑马鱼-海洋分枝杆菌(M. marinum)感染模型评估了AHA对分枝杆菌发病机制的体内影响。与未经处理的斑马鱼相比,经AHA处理的感染海洋分枝杆菌的成年斑马鱼的细菌负荷要低得多(图7 C),感染后14天(dpi)低负荷或非坏死肉芽肿的比例增加(图7 D、E)。而这种处理对感染海洋分枝杆菌ΔUreC的斑马鱼没有效果(图7 F、G)。
为了研究AHA对一种耐药菌株感染发病机制的治疗作用,用成年斑马鱼感染了耐利福平的海洋分枝杆菌(M. marinum-RR)。AHA与阳性对照乙胺丁醇(ethambutol, EMB)效果相当,显著降低M. marinum-RR和坏死性肉芽肿的CFU(图7 H-J)。此外,在小鼠多药耐药感染模型中,以贝达喹啉(bedaquiline, BDQ)为阳性对照,经AHA灌胃的C57BL/6小鼠肺组织免疫细胞浸润较少,炎性病变较少(图7 K、L)。AHA处理小鼠肺组织中的细菌负荷远低于未处理小鼠(图7 M)。

图7 抑制UreC可促进分枝杆菌的清除
本研究发现结核分枝杆菌蛋白UreC作为宿主DNA修复抑制剂,激活I 型IFN通路,促进脂滴和结核分枝杆菌的细胞内存活。我们发现UreC与RUVBL2的直接相互作用阻碍了RUVBL1-RUVBL2-RAD51复合物的形成,从而抑制宿主HR介导的DNA修复。基因组不稳定性的增加激活了cGAS/STING通路,诱导IFN-β通路,IFN-β通路通过上调SR-A1的表达,促进了Mtb的脂滴形成和细胞内存活。此外,UreC的缺失或抑制显著损害了Mtb在巨噬细胞和体内的存活。
总之,本研究发现UreC抑制宿主DNA修复并促进结核分枝杆菌的细胞内存活,UreC可能是结核病预防和治疗的潜在靶点。
-
 深化合作 | SCIEX全球副总裁蔡俊松一行来访百趣,共探合作新方向近日,SCIEX全球副总裁、中国区总经理蔡俊松先生与中国市场副总监江峥女士莅临上海百趣生物医学科技有限公司(以下简称“百趣生物”)苏州产能中心。此次访问,蔡俊松先生、江峥女士与百趣生物总裁邓军亮先生及市场中心总监程羿淳女士进行了深入的交流。2024-04-16
深化合作 | SCIEX全球副总裁蔡俊松一行来访百趣,共探合作新方向近日,SCIEX全球副总裁、中国区总经理蔡俊松先生与中国市场副总监江峥女士莅临上海百趣生物医学科技有限公司(以下简称“百趣生物”)苏州产能中心。此次访问,蔡俊松先生、江峥女士与百趣生物总裁邓军亮先生及市场中心总监程羿淳女士进行了深入的交流。2024-04-16 -
 薅羊毛 | 组学推荐,豪礼送不停时光荏苒,百趣生物已经迎来了第12个生日!我们始终坚守初心,致力于质谱技术在动植物生命科学和医学健康领域的研究与创新。在这个值得纪念的日子里,我们特别策划了一场“推荐有礼”活动,邀请广大科研小伙伴们共同参与,推荐您身边有组学需求的伙伴,成功签单,即可获得丰厚礼品!2024-03-13
薅羊毛 | 组学推荐,豪礼送不停时光荏苒,百趣生物已经迎来了第12个生日!我们始终坚守初心,致力于质谱技术在动植物生命科学和医学健康领域的研究与创新。在这个值得纪念的日子里,我们特别策划了一场“推荐有礼”活动,邀请广大科研小伙伴们共同参与,推荐您身边有组学需求的伙伴,成功签单,即可获得丰厚礼品!2024-03-13 -
 第37期代谢组学暨多元变量统计分析培训班由上海阿趣生物科技有限公司、Sartorius Stedim Data Analytics AB(简称Sartorius Stedim)联合主办,上海百趣代谢组学技术研究中心承办的“阿趣课堂第37期代谢组学暨多元变量统计分析培训”课程将于2024年04月20日-25日在上海举办。2024-03-13
第37期代谢组学暨多元变量统计分析培训班由上海阿趣生物科技有限公司、Sartorius Stedim Data Analytics AB(简称Sartorius Stedim)联合主办,上海百趣代谢组学技术研究中心承办的“阿趣课堂第37期代谢组学暨多元变量统计分析培训”课程将于2024年04月20日-25日在上海举办。2024-03-13 -
 新品发布 | 全面聚焦,探索一碳代谢新可能一碳代谢通路检测能精准定量生物体叶酸、四氢叶酸等代谢物浓度,为推动妇幼相关疾病研究及LDT转化提供新视角和新可能~2024-03-05
新品发布 | 全面聚焦,探索一碳代谢新可能一碳代谢通路检测能精准定量生物体叶酸、四氢叶酸等代谢物浓度,为推动妇幼相关疾病研究及LDT转化提供新视角和新可能~2024-03-05 -
 新品发布 | 直达CNS, 植需NGM尽管植物代谢组学数据的复杂,但为了解决“多”和“准”的核心需求,小趣特为植物领域工作者推出开工BUFF--植物NGM系列产品。2024-03-01
新品发布 | 直达CNS, 植需NGM尽管植物代谢组学数据的复杂,但为了解决“多”和“准”的核心需求,小趣特为植物领域工作者推出开工BUFF--植物NGM系列产品。2024-03-01 -
 项目文章(IF=27.5) | RIN基因新发现:通过根际分泌物塑造抑菌微生态,提升植物免疫力本研究发现植物发育基因可以通过对植物根系分泌物和微生物组组装的影响来控制微生物组介导的抗病性,从而使植物能够利用微生物组编码的基因和功能。2024-03-01
项目文章(IF=27.5) | RIN基因新发现:通过根际分泌物塑造抑菌微生态,提升植物免疫力本研究发现植物发育基因可以通过对植物根系分泌物和微生物组组装的影响来控制微生物组介导的抗病性,从而使植物能够利用微生物组编码的基因和功能。2024-03-01 -
 Cell | CUHK于君团队最新研究成果,除了幽门螺旋杆菌,还有你不知道的胃癌致病因子?胃癌(Gastric cancer, GC)是全球第五大常见癌症,也是导致癌症死亡的主要原因。幽门螺杆菌(Helicobacter pylori, H. pylori)是胃癌的主要危险因素,被列为I型致癌物。2024-02-05
Cell | CUHK于君团队最新研究成果,除了幽门螺旋杆菌,还有你不知道的胃癌致病因子?胃癌(Gastric cancer, GC)是全球第五大常见癌症,也是导致癌症死亡的主要原因。幽门螺杆菌(Helicobacter pylori, H. pylori)是胃癌的主要危险因素,被列为I型致癌物。2024-02-05 -
 百趣生物院士专家工作站——邓春晖教授签约仪式顺利举行2024年1月18日,上海百趣生物院士专家工作站一邓春晖教授签约仪式在上海百趣生物医学科技有限公司(以下简称百趣生物)总部顺利举行。复旦大学邓春晖教授、百趣生物CEO邓军亮等出席签约仪式。2024-01-22
百趣生物院士专家工作站——邓春晖教授签约仪式顺利举行2024年1月18日,上海百趣生物院士专家工作站一邓春晖教授签约仪式在上海百趣生物医学科技有限公司(以下简称百趣生物)总部顺利举行。复旦大学邓春晖教授、百趣生物CEO邓军亮等出席签约仪式。2024-01-22 -
 项目文章 | 蛋白质组学:看蚕豆-小麦间作系统如何击败尖孢镰刀菌与苯甲酸的威胁蚕豆(Vicia faba L.)是中国西南地区最重要的豆科作物之一。但长期单作,会导致蚕豆枯萎病发病率升高,产量和品质下降。已有研究表明,蚕豆与小麦间作可有效缓解蚕豆的自毒作用,抑制蚕豆枯萎病的发生。2024-01-18
项目文章 | 蛋白质组学:看蚕豆-小麦间作系统如何击败尖孢镰刀菌与苯甲酸的威胁蚕豆(Vicia faba L.)是中国西南地区最重要的豆科作物之一。但长期单作,会导致蚕豆枯萎病发病率升高,产量和品质下降。已有研究表明,蚕豆与小麦间作可有效缓解蚕豆的自毒作用,抑制蚕豆枯萎病的发生。2024-01-18 -
 百趣助力乳腺癌亚型新解析,开启乳腺癌治疗新篇章!百趣提供技术服务:非靶标代谢组+脂质组学2023-11-21
百趣助力乳腺癌亚型新解析,开启乳腺癌治疗新篇章!百趣提供技术服务:非靶标代谢组+脂质组学2023-11-21








