发表期刊:Phytomedicine
影响因子:6.656
作者单位:江苏省中医院
百趣提供服务:中药非靶标代谢组学
研究背景
作为一种炎症性肠病(inflammatory bowel disease, IBD),溃疡性结肠炎(ulcerative colitis, UC)常见于30-40岁的成年人,以腹痛、血性腹泻和里急后重为特征。5-氨基水杨酸(5-Aminosalicylic acid, 5-ASA)类、糖皮质激素类、生物制剂和免疫调节剂是UC的主要药物。尽管具有一定的治疗效果,但由于其副作用和高成本,这些药物的使用受到限制。因此,开发具有低不良反应率的替代治疗剂治疗UC势在必行。
辅助性T细胞17(T helper 17, Th17)的分泌物能介导炎症反应,在IBD患者的结肠粘膜中Th17细胞数增加。调节性T细胞(Regulatory T, Treg)具有维持免疫稳态的能力。IBD患者和患UC小鼠的Treg数均降低,UC的发生和发展受到Th17和Treg细胞之间不平衡的显著影响。
NOD样受体家族热蛋白结构域6(NOD-like receptor family pyrin domain containing 6, NLRP6)在肠道和肝脏中具有高水平的表达,并在调节炎症,维持上皮完整性和调节免疫稳态方面发挥作用。NLRP6在肠道细胞内募集ACS(Adaptor Apoptosis-associated Speck,一类蛋白,在症状严重的炎症部位中性粒细胞中ASC表达增多)形成炎症小体,最终与Caspase-1聚合共同参与促使IL-1β和IL-18(二者都属于白介素)成熟。IL-1β和IL-18对于炎症的调节起着重要的作用,与正常小鼠相比,NLRP6缺失的小鼠DSS诱导后表现出更严重的结肠炎症,同时IL-18水平降低。IL-18还能够维持结肠中的肠屏障完整性。IL-1β通过激活IL-1受体(IL-1R)信号传导促进Th17细胞分化和膨大。因此,预计NLRP6信号传导可能成为UC治疗的新靶点。
中药清肠化湿颗粒(以下简称为:QCHS)在中国广泛用于治疗溃疡性结肠炎。本文作者先前的研究证实QCHS颗粒和QCHS的多种中药成分在实验性结肠炎模型中的药理活性。然而,QCHS的作用机制和作用靶点有待进一步探索。本次研究就旨在评估QCHS对结肠炎的治疗效果并揭示其作用机制。
实验方法
在进行所有实验之前,使用UHPLC-QTOF-MS法对QCHS提取物中的有效成分进行了定性分析(由百趣生物提供)。后续实验流程如下:

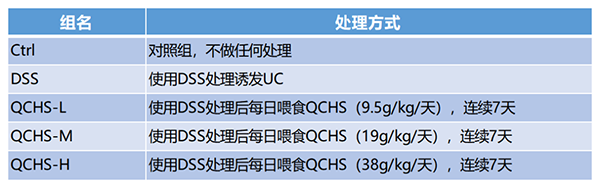
动物实验中实验分组名称与处理方式详见对照表:
表1. 动物实验组名称与处理方式对照表
实验结果
1.QCHS颗粒草药成分的UHPLC-QTOF-MS分析结果
正、负模式下QCHS提取液的总离子色谱图(TIC)如图1所示,鉴定了每种草药的代表性化合物质谱峰位置被标记在图上并列于表2。
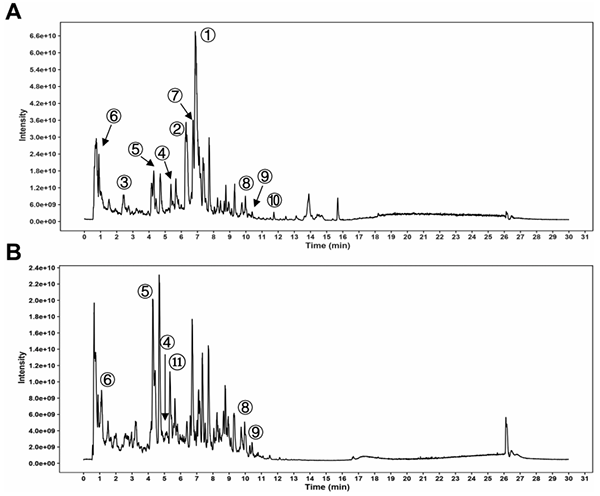
图1. 通过UHPLC-QTOF-MS分析QCHS的正(A)负(B)模式下总离子色谱图(TIC)
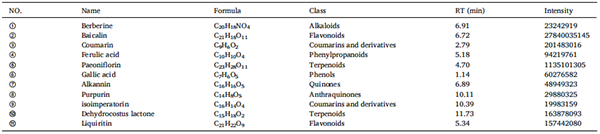
表2. QCHS中生物活性化合物的化学特性
2.QCHS能减轻小鼠DSS诱导的结肠炎
作者通过建立DSS诱导的UC模型以评估QCHS的作用(图2A)。DSS处理7天后,与对照组相比,模型组体重减轻,疾病活动指数(DAI)增加,结肠长度缩短,而QCHS和5-ASA治疗显著减轻了DSS诱导的UC症状(图2B–E)。H&E染色评估UC小鼠的病理损伤结果:DSS组结肠有隐窝丢失,炎性细胞浸润和明显的粘膜损伤。然而,QCHS和5-ASA明显缓解了结肠组织的病理状态(图2F)。总的来说,结果表明QCHS治疗改善了DSS诱导的UC小鼠的病理体征,高剂量QCHS的治疗效果优于5-ASA(图2B-F)。
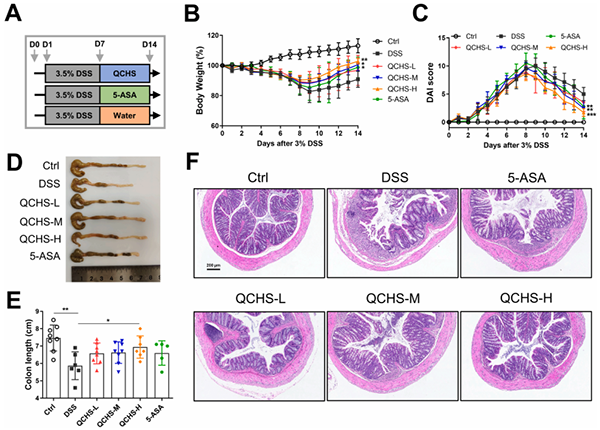
图2. QCHS治疗减轻了DSS诱导的小鼠结肠炎
3.QCHS治疗能抑制UC小鼠的结肠炎症反应
作者检测了血清中经典促炎细胞因子的水平。DSS给药可显著提高IL-6,IL-1β和肿瘤坏死因子-α(TNF-α)的水平,而QCHS治疗后可显著降低三者的水平(图3A-C)。丝裂原活化蛋白激酶(MAPK)和核因子-κB(NF-κB)的信号转导与炎症反应密切相关,数据表明QCHS治疗降低了MAPK(JNK,ERK和p38)(D)和NF-κB途径的核心分子:IKKα/β,IκBα和p65的磷酸化水平(E)。上述结果表明QCHS显著抑制了DSS诱导的炎症反应。
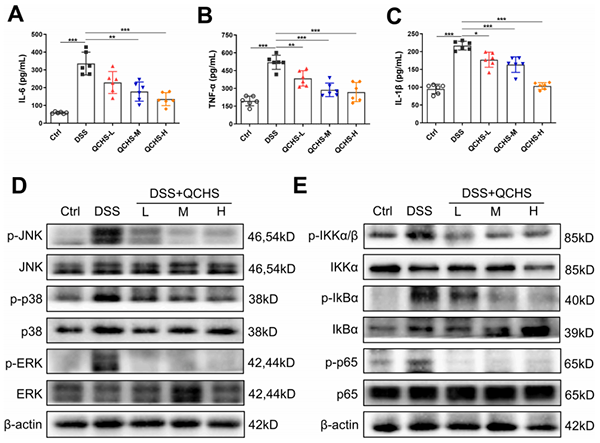
图3. QCHS抑制UC小鼠结肠组织的炎症反应4QCHS促进UC小鼠的粘膜完整性
如图所示,DSS诱导后杯状细胞的数量和粘蛋白产生的减少,但在QCHS处理后显著增加(图4A)。Claudin-5和粘蛋白2(Muc2)是维持肠屏障完整性的关键成分,从mRNA和蛋白质水平(B-D)来看,QCHS处理后两者都得到了改善。该数据表明,使用QCHS治疗可以增强UC小鼠的粘膜完整性。
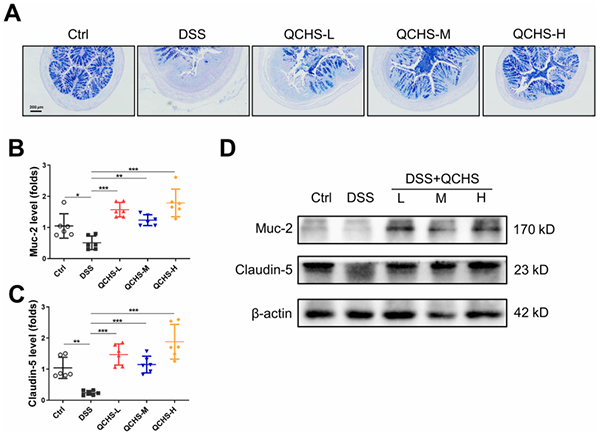
图4. QCHS改善UC小鼠肠粘膜的完整性
5.QCHS维持UC小鼠Th17/Treg的平衡
如图5A所示,QCHS处理后UC小鼠MLN中Th17的水平降低,同时Tregs的比例显著增加(图5B)。QCHS使Th17-特异性转录因子和细胞因子(RORγt,IL-17和IL-22)下调(图5C),而Treg的mRNA水平表征转录因子叉头框蛋白P3(Foxp3),细胞因子IL-10和TGF-β上调(图5D)。Western blot分析结果表明在蛋白质水平也有相同的趋势(图5E)。因此,QCHS重新调整了Th17和Tregs的平衡,以维持UC小鼠肠道免疫的稳态。
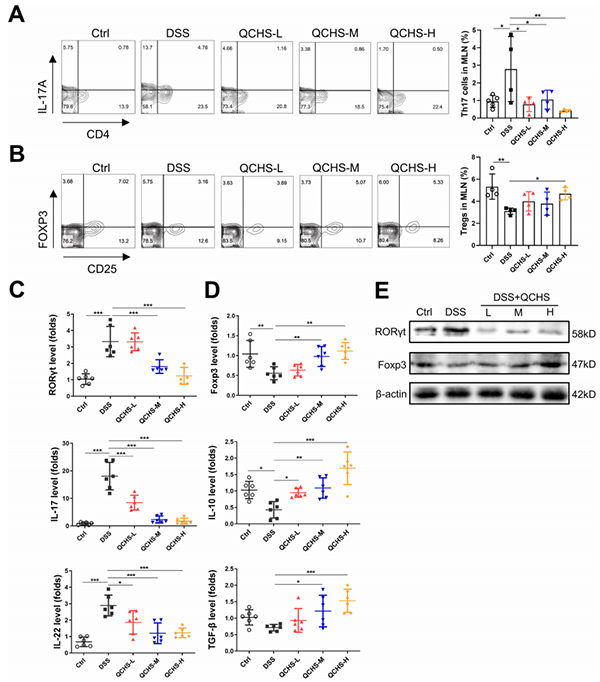
图5. QCHS纠正了UC小鼠的Th17/Treg失衡
6.NLRP6信号传导参与QCHS对UC小鼠的治疗作用
许多研究报道NLRP6在调节结肠炎和Th17分化中具有重要功能。检测NLRP6炎性体信号通路的激活情况,结果显示NLRP6在正常小鼠中高表达,但在DSS给药后显著降低,随后通过QCHS处理,这种趋势发生逆转(图6A)。DSS给药后,小鼠结肠组织中核心炎性体成分NLRP6,ASC和IL-18的mRNA水平降低,但QCHS治疗后显著升高(图6B-D);DSS处理后Caspase-1的表达增加,又经QCHS处理后其表达明显降低(图6E)。Western blot结果表明,QCHS激活NLRP6和ASC的表达,同时调节IL-1β和IL-18的成熟(图6F),结果表明QCHS可能对体内NLRP6信号传导具有调节作用。
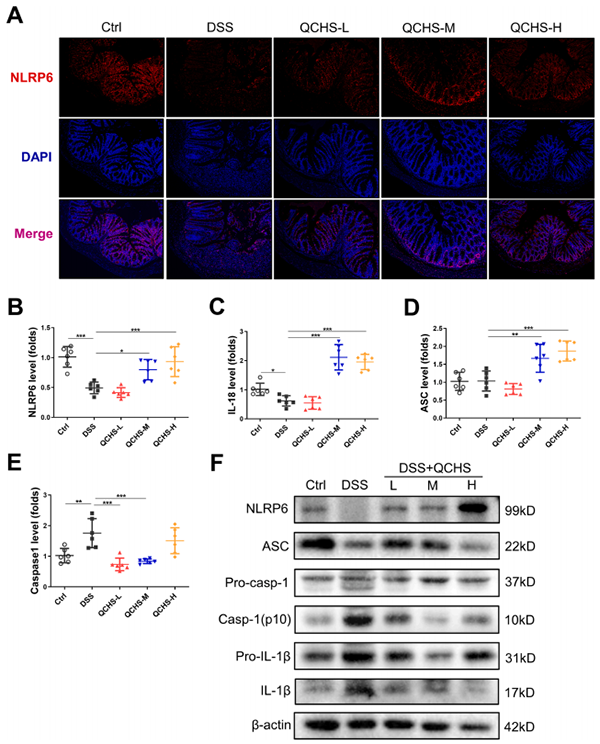
图6. QCHS促进体内NLRP6炎性体信号传导途径的激活
7.QCHS在体外抑制LPS诱导的炎症并激活NLRP6信号传导
作者通过用LPS(1μg/ml)建立细胞炎症模型,评估含QCHS血清的作用。结果使用含QCHS的血清处理后显著降低了IL-6、IL-1β和TNF-α的相对水平(图7B-D)。同样,NLRP6炎症小体信号通路的主要分子NLRP6、IL-18和ASC在LPS刺激下降低,但在含QCHS的血清处理后显著升高(图7E-G)。Western blot分析条带的结果与体内实验也相似(图7I)。这些结果显示,含QCHS的血清影响了体外炎症反应,其机制可能与NLRP6通路有关。
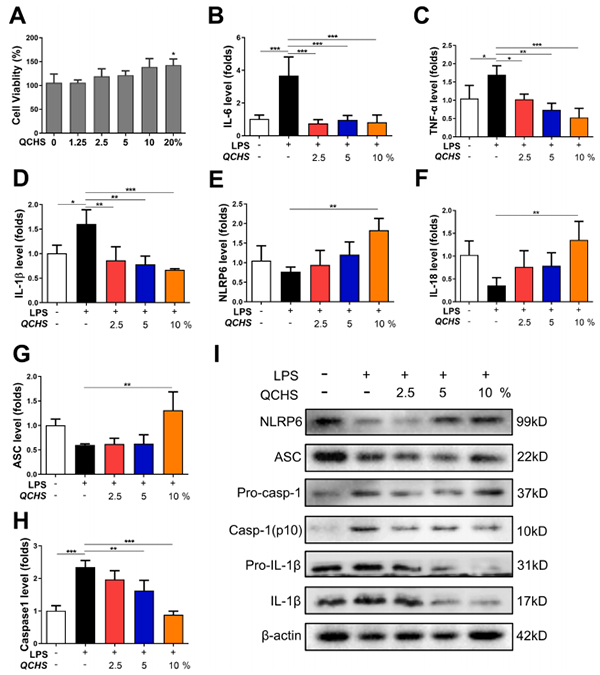
图7. 含有QCHS的血清抑制LPS诱导的细胞炎症并激活NCM-460细胞中的NLRP6信号传导途径
为了揭示NLRP6是否是QCHS介导的炎症反应调节的功能靶标,使用转染NLRP6小干扰RNA(siNLRP6)以干扰正常人肠上皮细胞系NCM-460中NLRP6的表达。结果表明,阻断NLRP6信号传导可能导致QCHS的炎症调节作用的消除(图8)。因此,可以认为QCHS的治疗效果与NLRP6的激活有关。
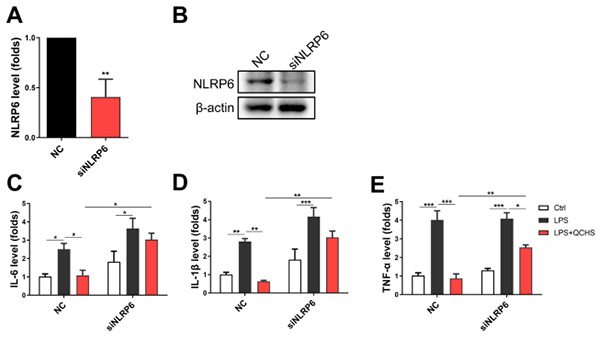
图8. NLRP6干扰消除了QCHS介导的细胞炎症调节
讨论与总结
在正常状态下,Th17细胞分泌特定的炎性细胞因子以维持宿主免疫,而Tregs抑制Th17的过度激活以保持平衡的免疫功能。Th17异常升高或Treg功能缺陷可能导致UC的发展。因此,靶向调节Th17/Treg是治疗UC的有效方法,植物药物是潜在的治疗剂。IL-18和IL-1β的成熟直接依赖于NLRP6的激活。因此,NLRP6信号有望成为UC的新靶点。
然而,目前的药物仍然主要用于维持或诱导缓解,由于这些药物的缺陷,UC患者仍然面临“治疗上限”。有积极迹象表明,中药在治疗UC方面具有潜在的治疗能力。在中国的一项随机临床试验中,QCHS已被临床证明对活动期UC有效且安全。
本次研究中报道了QCHS的治疗效果,并揭示了QCHS在UC小鼠中的可能机制。QCHS治疗减轻了UC的症状,表现为体重和结肠长度的恢复,DAI指数降低,粘膜损伤减轻。此外,与5-ASA相比,高剂量QCHS显示出优异的治疗效果。QCHS治疗还抑制了过度的炎症反应,在UC小鼠中保持结肠的粘膜完整性有助于UC小鼠结肠粘膜的深度愈合。最重要的是,本研究探索了QCHS的免疫调节功能。QCHS重新平衡了Th17/Treg的水平,从而保护小鼠免受结肠炎。从机制上讲,NLRP6炎性体信号通路参与QCHS介导的UC保护(图9)。QCHS显著激活NLRP6的表达并调节IL-1β和IL-18的成熟,因此发挥抗炎作用。进一步的体外实验表明,QCHS的功能依赖于NLRP6的激活。
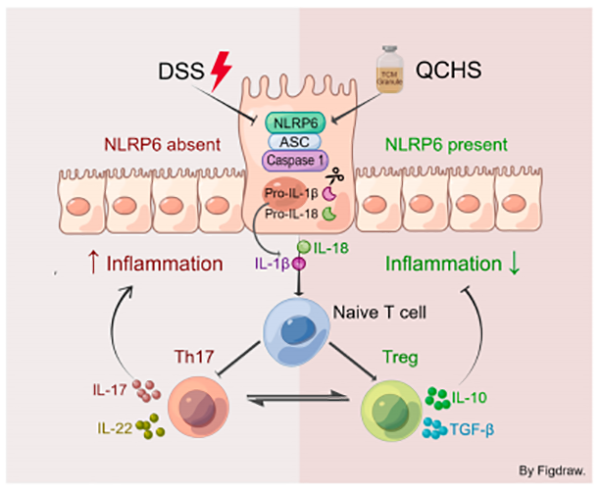
图9. QCHS免疫调节和结肠保护作用的图形摘要
综上所述,QCHS对UC的临床治疗效果是肯定的,但其作用机制仍不清楚。本次研究结果探索了QCHS的可能靶点,为QCHS的抗炎和免疫保护作用提供了证据,并可能为其作为UC替代治疗策略的发展提供机制基础。
文献下载链接:
https://pan.baidu.com/s/1aaMGk0rjHjoshmviaH3q1A
提取码:0000










