结直肠癌是全球第三常见的癌症,约占所有癌症病例的10%,并且是癌症相关死亡的第二大原因。2020中国新增结直肠癌患者56万,新增死亡患者29万。诸如饮食、久坐不动、肥胖等生活方式因素,都会显著增加罹患结直肠癌的风险。此外,结直肠癌常常在治疗选择有限的晚期才被诊断出来,所以研究结直肠癌生物标志物对于提高诊断和治疗的准确性、改善患者的预后以及推动癌症研究都具有重要意义。


1. 从大型队列中识别了健康人群、结直肠腺瘤患者(Colorectal adenoma, CRA)和结直肠癌(Colorectal cancer, CRC)患者血浆及粪便代谢组的代谢物特征变化。
2. 发现了油酸和别胆酸是结直肠癌进展的关键代谢物,它们通过结合肿瘤细胞上的受体分别发挥着促进和抑制肿瘤生长的作用。
3. 发现了血浆中代谢生物标志物的诊断效果要优于粪便中的代谢生物标志物。
4. 发现了17个代谢物组成的代谢生物标志物组合在多个独立中心队列中均能够很好的筛选出结直肠癌患者。
5. 血浆代谢物在结直肠癌和结直肠腺瘤患者的无创诊断中均具有很好的诊断潜力。
结直肠癌(CRC)是全球癌症死亡的主要原因,近期许多研究发现微生物代谢物与结直肠癌密切相关。以往的研究表明,CRC患者肠道内诸如氧化三甲胺(Trimethylamine N-oxide, TMAO)、脱氧胆酸等促进肿瘤细胞生长的代谢物含量升高,同时短链脂肪酸、吲哚衍生物等抗癌物质含量降低,这些物质会被吸收进血液循环,进而影响人体免疫功能。此外,这些血液中的微生物代谢在结直肠癌(CRC)和结直肠腺瘤(CRA)患者中都有显著的变化,但目前还不清楚粪便和血液代谢组是如何在腺瘤至腺癌癌变过程中发生改变的,还需要进一步的研究来说明血液循环中的代谢物是否会影响CRC的进展。
1. CRC进展期血浆和粪便代谢物的变化
为了研究CRC的代谢组学特征,发现队列纳入了373份血浆样本,其中包括119例结直肠癌(CRC)患者、143例结直肠腺瘤(CRA)患者和111例作为正常对照(Normal controls, NC)的健康人群(图1)。
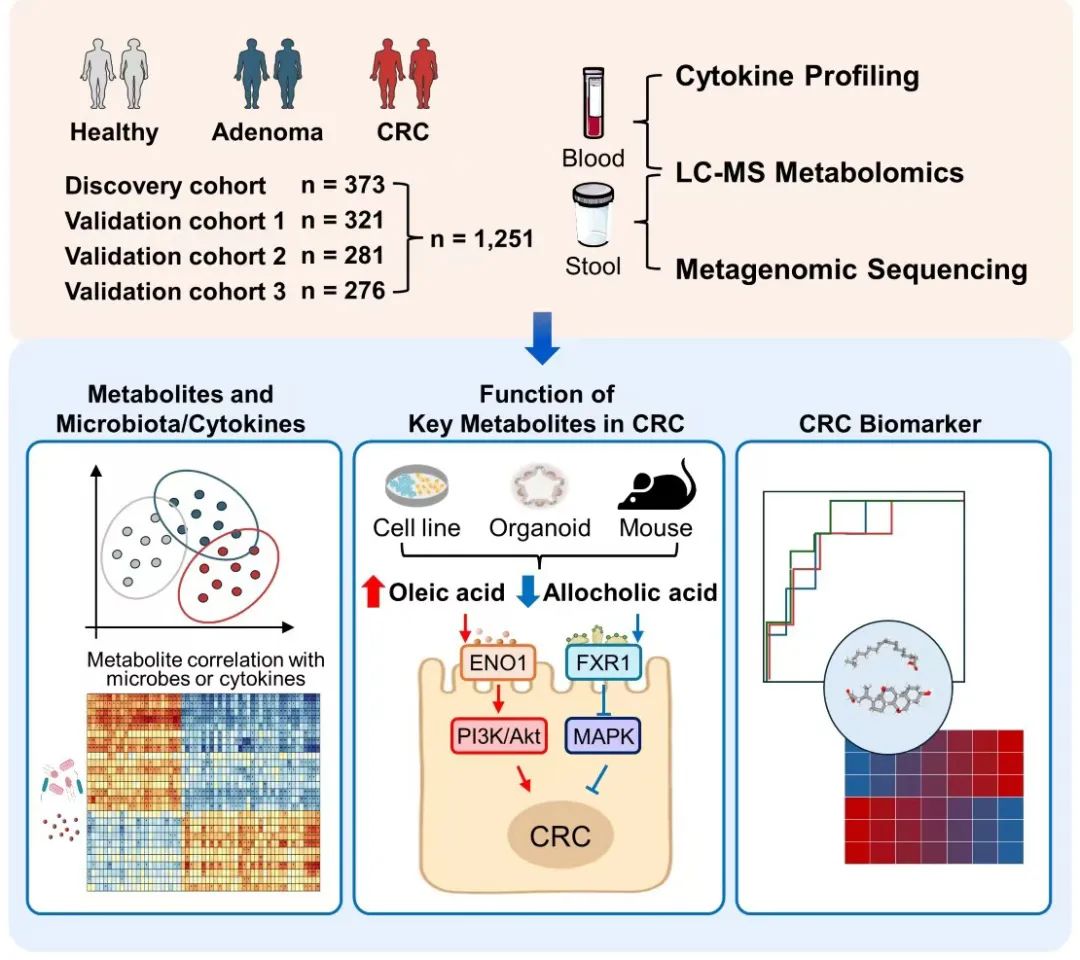
图1. 代谢组学研究流程图
首先对血浆样本中的代谢物进行了非靶向代谢组学分析,排除食物衍生代谢物和外源性代谢物干扰后,最终确定了1026种内源性小分子代谢物。进一步通过PLS-DA和OPLS-DA统计建模分析表明CRC、CRA分别和NC比较的血浆代谢组均存在显著差异(图2A)。此外,配对检验分析也发现在NC、CRA和CRC中,存在差异的血浆代谢物变化具有一致性,其中22种代谢物含量沿着腺瘤-癌变过程(CRA-CRC)依次上调,包括犬尿氨酸、二氢胸腺嘧啶、多种脂肪酸(如油酸)(图2B和2C)。同时34种代谢物含量沿CRA-CRC依次下调,如别胆酸、组氨酸等。
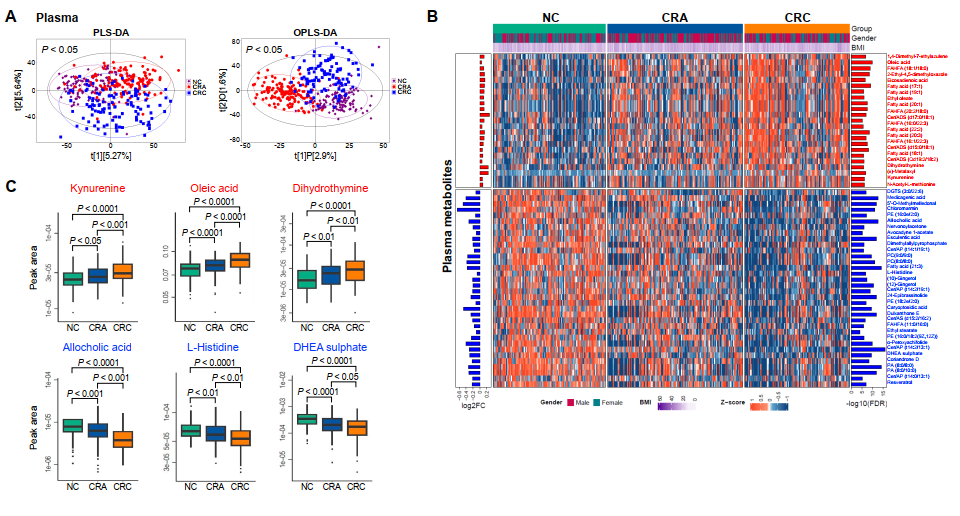
图2. 癌症进展阶段微生物代谢物的变化
此外,我们还观察到与非晚期腺瘤患者相比,晚期腺瘤患者血浆中的促肿瘤代谢物含量(包括犬尿氨酸和石胆酸甘氨酸共轭物)明显富集增加,同时硫酸脱氢表雄酮、苯酚和吲哚类含量则被不断耗竭降低。
2. 微生物代谢物在CRC进展阶段中的相关性和功能作用
为了更进一步阐释随着CRC发病进程中发生改变的这些代谢物功能意义,本研究我们对代谢物进行了功能富集分析,研究发现与NC组相比,CRC血浆代谢组学中前三个显著差异代谢通路途径分别是:(1)α-亚麻酸和亚油酸代谢途径,(2)组氨酸代谢途径,(3)同型半胱氨酸降解途径(图3A)。CRC粪便代谢组中前三个显著差异代谢通路途径分别是:(1)组氨酸代谢途径,(2)丙氨酸代谢途径,(3)葡萄糖-丙氨酸循环途径(图3B)。通过相关性网络分析发现表明CRC血浆(图3C)和粪便(图3D)代谢组中的差异代谢物绝大多数都与脂质代谢途径有关。此外,研究发现了9种与CRC血浆和粪便代谢组明显相关的代谢物(图3E),特别是油酸和组氨酸,它们处于相关网络分析图的中心,这对于CRC进展的血浆和粪便代谢组都有重要研究意义。通过相关性分析还发现,CRC进展阶段中血浆和粪便代谢物之间显著相关的代谢物较少(图3E)。
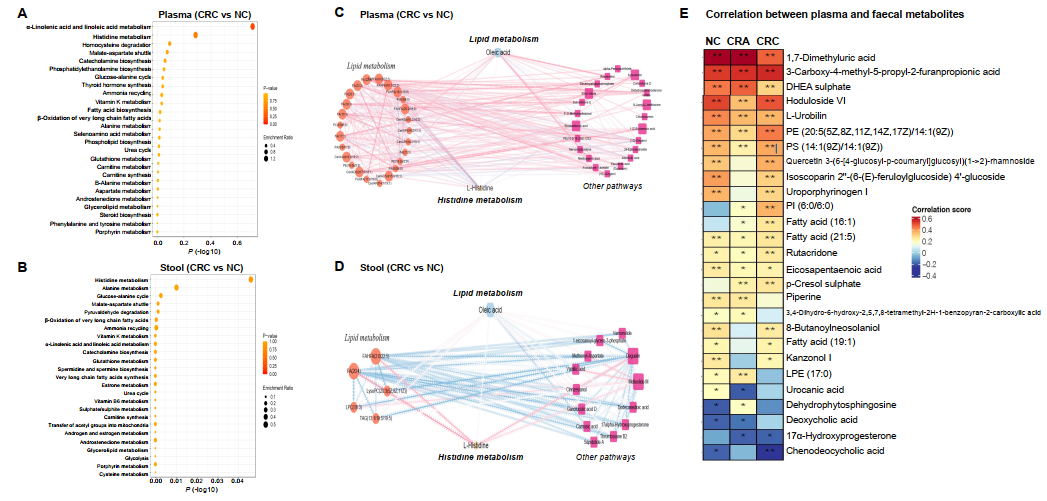
图3. 微生物代谢物在CRC进展阶段中的相关性和功能作用
3. 小鼠CRC肿瘤发生过程中关键代谢物的功能验证
随后我们进行了小鼠的体内功能验证研究,给CRC肿瘤模型小鼠口服油酸(图4A),结果发现与对照组相比,油酸显著增加了结肠肿瘤的大小和肿瘤负荷(图4B)。组织学评估证实了小鼠结肠肿瘤的发生(图4C),油酸明显增加了增殖癌细胞的比例(图4D)。相应的,使用别胆酸进行干预(图4E),结果发现小鼠结肠肿瘤较少。与对照组相比别胆酸显著减少了小鼠的肿瘤大小和肿瘤负荷(图4J)。组织学检查证实了别胆酸处理降低了增殖癌细胞的比例(图4L)。在转基因造模的CRC肿瘤小鼠模型中再次验证了上述结果。
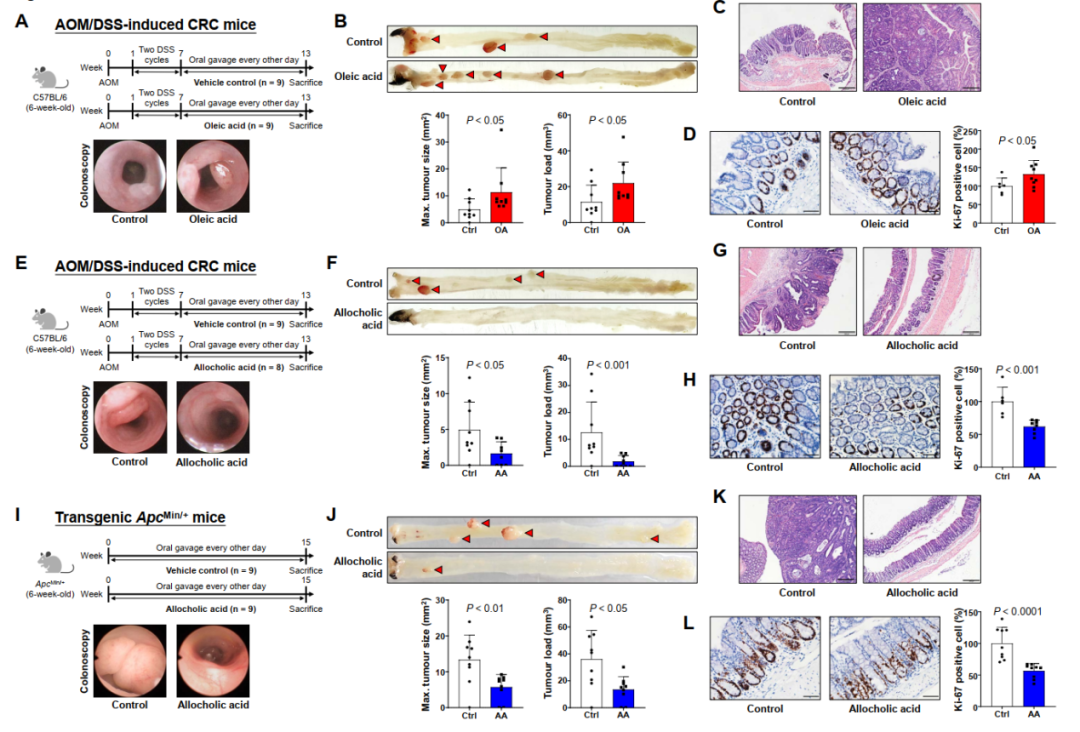
图4. 关键代谢物在CRC小鼠模型中的功能验证
4. 确定CRC中关键代谢物的结合受体
为了深度挖掘代谢物是如何进一步影响肿瘤细胞的作用机制,本研究我们对CRC细胞进行了有限蛋白水解质谱分析(LiP-MS)以探索代谢物与肿瘤细胞的相互作用。在鉴定出的241个与油酸结合的候选肽段中,我们发现α-烯醇化酶(ENO1)差异最显著,分子对接分析显示,油酸通过烷基相互作用与ENO1的Arg49残基结合,解离常数为10.6 μM(图5B-C)。沉默ENO1表达后,油酸的促肿瘤作用被消除(图5D),且ENO1拮抗剂AP-III-a4逆转了油酸诱导的细胞活力增加(图5E),最终证实ENO1是油酸在CRC细胞中的结合受体。
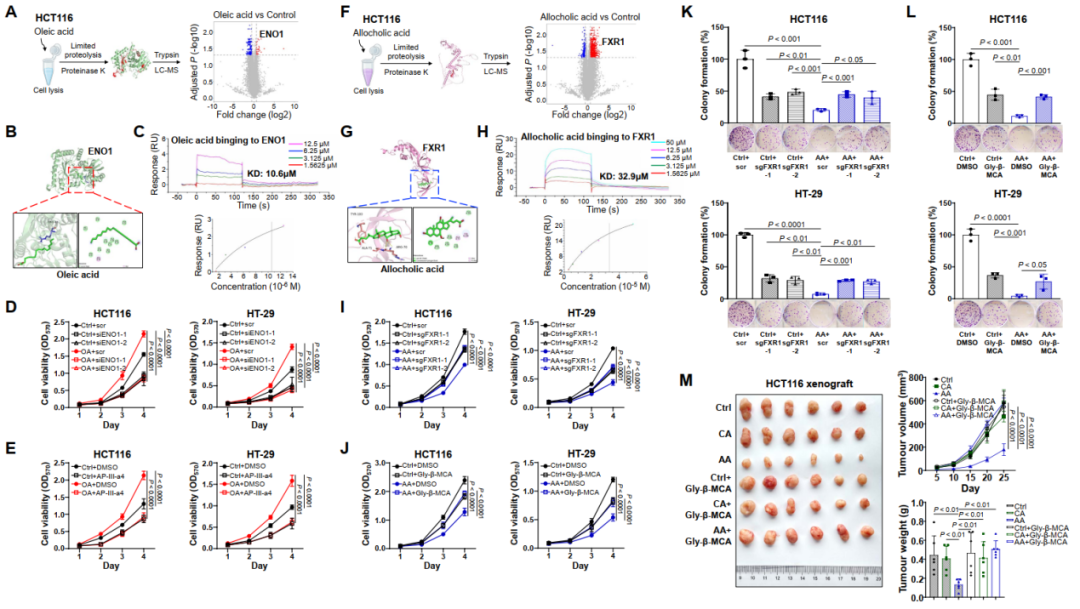
图5. 识别CRC中关键代谢物的结合受体
对别胆酸处理的CRC细胞进行LiP-MS分析,发现差异最大的肽是法尼醇X受体(Farnesoid X receptor,FXR1)(图5F)。分子对接分析显示,别胆酸通过氢键与FXR1的Arg70残基结合,解离常数为32.9 μM(图5G-H)。沉默FXR1后,别胆酸失去了抗肿瘤作用(图5I),且FXR1拮抗剂甘氨酸-β-木胆酸消除了别胆酸的保护作用(图5J)。此外,FXR1-sgRNA(图5K)或FXR1拮抗剂(图5L)均能逆转别胆酸导致的癌细胞增殖减少。体外实验结果也显示,与仅接受别胆酸的小鼠相比,联合FXR1拮抗剂处理的小鼠肿瘤生长和肿瘤重量显著增加(图5M),这些结果表明别胆酸对CRC的保护作用依赖于FXR1。
5. 识别关键代谢物改变的CRC信号通路
为了进一步解析潜在机制,我们又对CRC细胞进行了转录组学分析。KEGG和GSEA通路分析显示,PI3K/Akt是油酸诱导的最大富集通路途径(图6A)。油酸激活增加了磷酸化的JAK1、PI3K和AKT在人源CRC细胞中的蛋白表达,这种上调被ENO1 siRNA或ENO1拮抗剂AP-III-a4逆转(图6B)。同时在补充了油酸干预的小鼠结肠肿瘤组织中证实了PI3K/Akt通路标记物蛋白表达的增加(图6C)。这些发现表明,油酸与CRC细胞中的ENO1结合,进而激活了致癌的PI3K/Akt信号通路。
另一方面,MAPK是别胆酸诱导的最大消耗通路途径(图6D)。别胆酸明显降低了人源CRC细胞中MAPK通路标志物以及细胞增殖和细胞周期标志物的蛋白表达,而FXR1-sgRNA、FXR1拮抗剂甘氨酸-β-木胆酸(图6E)逆转了这种下调关系。这些MAPK通路的蛋白标志物在补充了别胆酸干预的小鼠结肠肿瘤组织中也出现了下调变化(图6F),这表明别胆酸与FXR1之间的结合进一步导致了CRC中MAPK信号通路的失活。
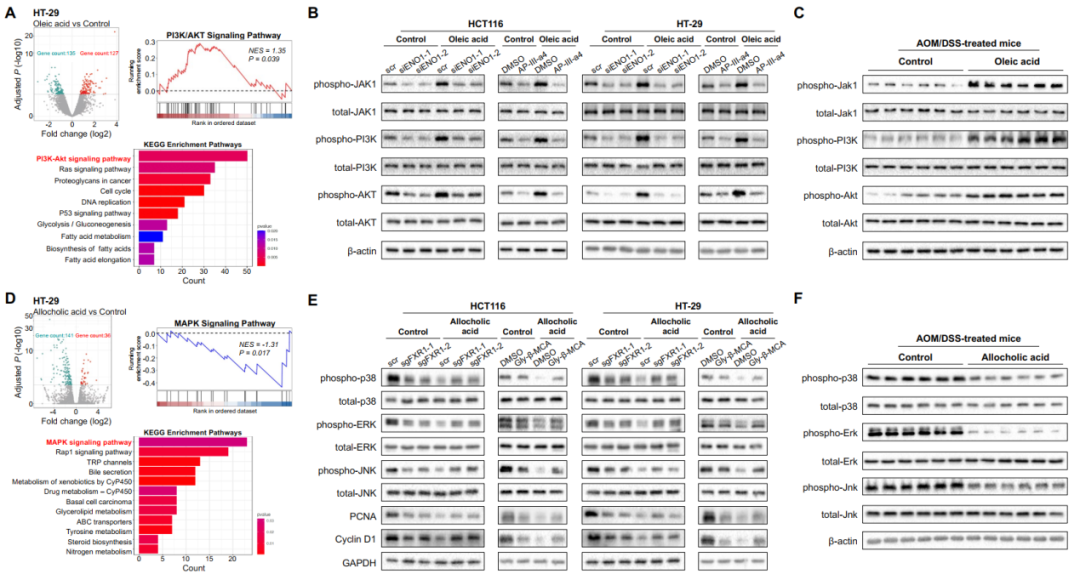
图6. 确定CRC中被关键代谢物改变的信号通路
6. 血浆代谢物比粪便代谢物在CRC诊断中表现更佳
我们还分析了代谢物组合作为CRA和CRC诊断标志物的应用。利用前面已确定的差异血浆代谢物,我们分别建立了LASSO、随机森林和逻辑回归模型进行CRC分类。在校正了包括年龄、性别、体重指数(BMI)和肿瘤位置在内的四个临床干扰因素后,我们最终筛选出一套包含17种血浆代谢生物标志物组合,它在区分CRC和NC方面表现优异,其中,LASSO方法的AUC结果为0.927,随机森林方法的AUC结果为0.891,逻辑回归模型的AUC结果为0.846。同时基于19种粪便代谢生物标志物通过LASSO方法的AUC结果为0.916(图7A),随机森林方法的AUC结果为0.839,逻辑回归模型的AUC结果为0.8。
值得注意的是,我们比较了所有模型的AUC结果后发现,在区分CRC与NC组方面,血浆标志物组合的AUC结果(AUC:0.846-0.927)整体要优于粪便标志物组合(AUC:0.800-0.916)。此外,血浆粪便联合标志物组合在区分CRC与NC组以及CRC与CRA组方面的性能,也与仅血浆代谢组组合结果相似。由此可见,血浆代谢标志物组合模型在区分CRC和NC方面整体要优于粪便代谢标志物组合模型。
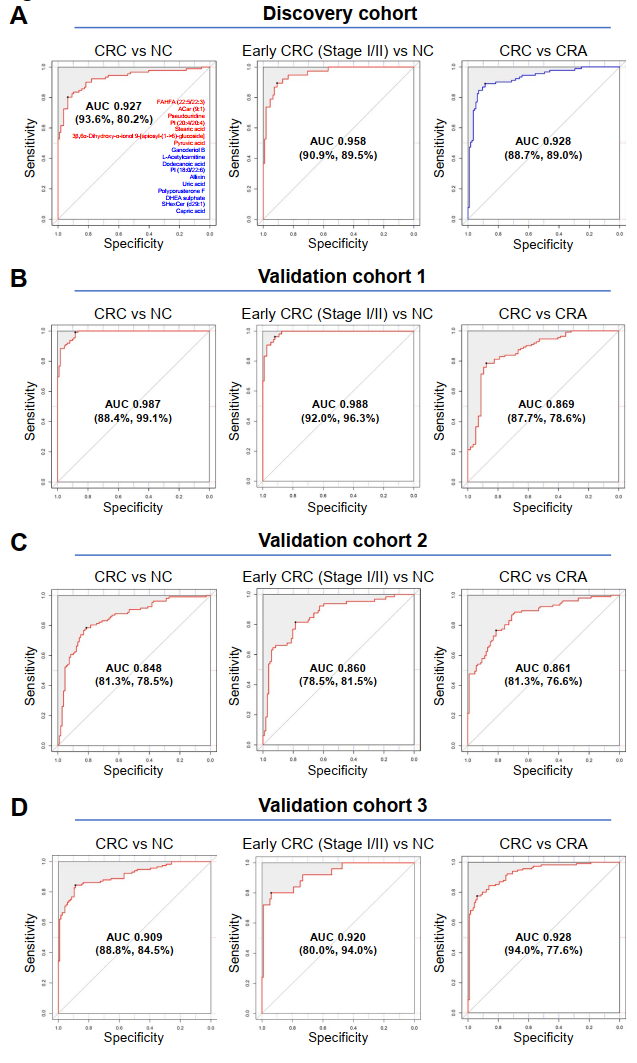
图7. 诊断不同阶段CRC的血浆代谢标志物组合模型
7. 三个独立中心队列验证诊断CRC的血浆代谢标志物组合模型
我们同样建立了一个独立中心的验证队列(验证队列1),以验证我们发现的17种血浆代谢标志物的诊断性能。这17种血浆标志物组合在验证队列1(n=321)中区分CRC和NC的AUC为0.987,区分早期CRC(I/II期)和NC的AUC为0.988(图7B)。它在鉴别CRC和CRA方面也表现很出色,AUC为0.869。在另一个独立中心的验证队列2(n=281)中,该模型在区分CRC和NC方面,和区分早期CRC(I/II期)和NC方面均表现出色,AUC分别为0.848和0.860(图7C),其区分CRC和CRA的AUC为0.861。
此外,为确保地区差异不会对诊断结果产生影响,我们进一步构建了来自第三个独立中心的验证队列3,在验证队列3(n=276)中,该模型区分CRC和NC的AUC为0.909,区分早期CRC(I/II期)和NC的AUC为0.920(图7D)。它在区分CRC和CRA方面也表现优异,AUC为0.928,与其他验证队列的结果一致。因此,发现队列和三个独立中心验证队列之间一致的结论,最终证实了我们筛选出的这套17种血浆代谢标志物在CRC诊断中的良好性能效果。
本研究通过探索大规模队列中CRC进展的代谢组学特征,及代谢物在CRC进展中的功能意义,建立了一个血浆代谢标志物诊断模型,该模型能够以高灵敏度和特异性准确区分早期CRC患者。血浆代谢物可作为用于CRC患者无创早期诊断的生物标记物,具有重要的潜在应用价值。










